Síntesis de cetonas de Weinreb
La síntesis de cetonas de Weinreb es una reacción química utilizada en la química orgánica para formar enlaces carbono-carbono . Fue descubierta en 1981 por Steven M. Weinreb y Nahm Steven como un método para sintetizar cetonas.[1] La reacción original incluía dos sustituciones nucleofílicas con grupo acilo:
- la conversión de un cloruro de ácido en una N, O-dimetilhidroxiamida, conocida como amida de Weinreb,
- el tratamiento posterior de la amida de Weinreb con un reactivo organometálico, como un reactivo de Grignard o un reactivo de organolitio .
Nahm y Weinreb también informaron de la síntesis de aldehídos por la reducción de la amida con un exceso de hidruro de litio y aluminio (Ver reducción de la amida ).

La principal ventaja de este método sobre la adición de reactivos organometálicos a compuestos de acilo es que se evita el problema común de adiciones posteriores indeseadas en donde se forma un alcohol:

Las amidas de Weinreb se han empleado regularmente por los químicos orgánicos como un método confiable para síntesis de cetonas. Una aplicación muy extendida es su uso en síntesis de productos naturales.
Mecanismo
[editar]Weinreb y Nahm propusieron el siguiente mecanismo de reacción para explicar la selectividad que se observa en las reacciones de las amidas de Weinreb. Su propuesta fue que el intermediario tetraédrico ( A) se forma como resultado de la sustitución nucleofílica de acilo por el reactivo organometálico y se estabiliza por la quelación del grupo metoxi.[1] Este intermediario es estable sólo a bajas temperaturas.
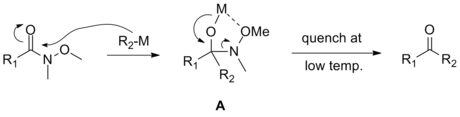
Este quelante es la diferencia con las condiciones de las adiciones posteriores cuando se utilizan derivados carboxílicos convencionales. La conjetura del mecanismo por parte de Weinreb fue aceptada de inmediato por la comunidad académica, pero no fue hasta 2006 que fue confirmada por análisis espectroscópicos y cinéticos.[2]
Preparación
[editar]Además de la técnica original que se muestra arriba (que puede tener problemas de compatibilidad para sustratos sensibles), las amidas de Weinreb se pueden sintetizar a partir de una variedad de derivados de ácidos carboxílicos. La gran mayoría de estos procedimientos utilizan la sal disponible en el mercado, el clorhidrato de N, O-dimetilhidroxilamina [MeO (Me) NH • HCl], que suele ser más fácil de manejar que la amina libre.[3] El tratamiento de un éster o lactona con Alme 3 o Alme 2 Cl produce la amida de Weinreb correspondiente con buenos rendimientos. Por otra parte, los reactivos de Grignard no nucleofílicos, tales como cloruro de isopropílmagnesio, pueden ser utilizados para activar la amina antes de la adición del éster.[4]

Una gran variedad de reactivos utilizados en síntesis de péptidos se pueden utilizar para preparar amidas de Weinreb de ácidos carboxílicos. Varias carbodiimidas, hidroxibenzotriazoles, y trifenilfosfinas se han reportadoespecíficamente para este propósito.[3][4]

Finalmente, una reacción aminocarbonilación reportada por Stephen Buchwald permite la conversión de halogenuros de arilo directamente a amidas de Weinreb aromáticas.[5]

Alcance
[editar]Las condiciones estándar para la síntesis de cetonas de Weinreb toleran una amplia variedad de grupos funcionales en otras partes de la molécula, incluyendo la sustitución de α-halógeno, N-aminoácidos protegidos, éteres de sililo α-β isaturados, lactamas y lactonas diferentes, sulfonatos, sulfinatos, y ésteres de fosfonato.[3][4] Una amplia variedad de nucleófilos se puede utilizar en conjunción con la amida. Los reactivos de Grignard y los organolitios son los más comúnmente empleados; algunos ejemplos que involucran nucleófilos de carbono alifáticos, vinílicos, aromáticos y acetilénicos han sido reportados. Sin embargo, con nucleófilos muy básicos o con alto impedimento estérico, la eliminación de la fracción de metóxido en forma de formaldehído puede ocurrir como una reacción secundaria significativa.[6]

Sin embargo, la amida de Weinreb ocupa un lugar destacado en muchas síntesis, sirviendo como una herramienta poderosa importante para el acoplamiento de varios fragmentos. A continuación se muestran los pasos clave relacionados con las amidas de Weinreben durante la síntesis de varios productos naturales, incluidos los miembros de la familia de inmunosupresores Macrosfélidos, el anfidinólido J y la familia de antibióticos de las espirofunginas.[7][8][9]

Variaciones
[editar]La reacción de amidas de Weinreb con reactivos de Wittig se ha realizado para evitar algunas condiciones duras necesarias para la adición de reactivos de hidruro de compuestos organometálicos. El resultado es una N-metil-N-metoxi-enamina que se convierte en la correspondiente cetona o aldehído.[10]

Además, se ha desarrollado un intercambio de magnesio-halógeno con arilación posterior, mostrándose así la estabilidad de la amida de Weinreb y esto proporciona un método operativo simple para la síntesis de aril cetonas.[11]

Se han sintetizado amidas de Weinreb con múltiples grupos funcionales más inusuales, funcionando como sintones de CO2 y α-dicetonas.[12][13]

Por último, Stephen G. Davies de Oxford ha diseñado un auxiliar quiral que combina la funcionalidad de la amida de Weinreb con la de Myers para pseudoefedrina, permitiendo así la alquilación diastereoselectiva del enolato, seguido por la ruptura simple de los correspondientes aldehídos o cetonas ópticamente activos.

Referencias
[editar]- ↑ a b Nahm, S.; Weinreb, S. M. (1981), «N-methoxy-n-methylamides as effective acylating agents», Tetrahedron Letters 22: 3815, doi:10.1016/s0040-4039(01)91316-4.
- ↑ Qu, B.; Collum, D. B. (2006), «Mechanism of Acylation of Lithium Phenylacetylide with a Weinreb Amide», The Journal of Organic Chemistry 71: 7117, doi:10.1021/jo061223w.
- ↑ a b c Singh, J.; Satyamurthi, N.; Aidhen, I. S. (2000). «The Growing Synthetic Utility of Weinreb′s Amide». Journal für praktische Chemie 342: 340. doi:10.1002/(sici)1521-3897(200004)342:4<340::aid-prac340>3.0.co;2-1.
- ↑ a b c Mentzel, M.; Hoffmann, H. M. R. (1997). «N-methoxy-N-methylamides (Weinreb amides) in modern organic synthesis». Journal für Praktische Chemie/Chemiker-Zeitung 339: 517. doi:10.1002/prac.19973390194.
- ↑ Martinelli, J. R.; Freckmann, D. M. M.; Buchwald, S. L. (2006). «Convenient Method for the Preparation of Weinreb Amides via Pd-Catalyzed Aminocarbonylation of Aryl Bromides at Atmospheric Pressure». Organic Letters 8: 4843. doi:10.1021/ol061902t.
- ↑ Graham, S. L.; Scholz, T. H. (1990), «A new mode of reactivity of N-methoxy-N-methylamides with strongly basic reagents», Tetrahedron Letters 31: 6269, doi:10.1016/s0040-4039(00)97039-4.
- ↑ Paek, S.-M.; Seo, S.-Y.; Kim, S.-H.; Jung, J.-W.; Lee, Y.-S.; Jung, J.-K.; Suh, Y.-G. (2005). «Concise Syntheses of (+)-Macrosphelides A and B». Organic Letters 7: 3159. doi:10.1021/ol0508429.
- ↑ Barbazanges, M.; Meyer, C.; Cossy, J. (2008), «Total Synthesis of Amphidinolide J», Organic Letters 10: 4489, doi:10.1021/ol801708x.
- ↑ Shimizu, T.; Satoh, T.; Murakoshi, K.; Sodeoka, M. (2005), «Asymmetric Total Synthesis of (−)-Spirofungin A and (+)-Spirofungin B», Organic Letters 7: 5573, doi:10.1021/ol052039k.
- ↑ Hisler, K.; Tripoli, R.; Murphy, J. A. (2006). «Reactions of Weinreb amides: formation of aldehydes by Wittig reactions». Tetrahedron Letters 47: 6293. doi:10.1016/j.tetlet.2006.06.118.
- ↑ Conrad, K.; Hsiao, Y.; Miller, R. (2005). «A practical one-pot process for α-amino aryl ketone synthesis». Tetrahedron Letters 46: 8587. doi:10.1016/j.tetlet.2005.09.183.
- ↑ Whipple, W. L.; Reich, H. J. (1991). «Use of N,N'-dimethoxy-N,N'-dimethylurea as a carbonyl dication equivalent in organometallic addition reactions. Synthesis of unsymmetrical ketones». The Journal of Organic Chemistry 56: 2911. doi:10.1021/jo00008a057.
- ↑ Sibi, M. P.; Sharma, R.; Paulson, K. L. (1992). «N,N′-Dimethoxy-N,N -Dimethylethanediamide: A Useful α-Oxo-N-Methoxy-N-Methylamide and 1,2-Diketone Synthon». Tetrahedron Letters 33: 1941. doi:10.1016/0040-4039(92)88108-h.
