Trachelanthamidin
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
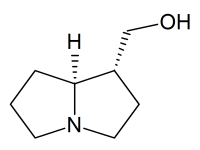
| |||||||||||||
| Allgemeines | |||||||||||||
| Name | Trachelanthamidin | ||||||||||||
| Andere Namen |
(1R,7aS)-Hexahydro-1H-pyrrolizin-1-ylmethanol (IUPAC) | ||||||||||||
| Summenformel | C8H15NO | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 141,21 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||
Trachelanthamidin ist ein einfaches Pyrrolizidinalkaloid, das bei der Biosynthese verschiedener anderer Pyrrolizidinalkaloide auftritt.[2]
Vorkommen
[Bearbeiten | Quelltext bearbeiten]
Trachelanthamidin wurde vor allem in Arten der Gattung Heliotropium nachgewiesen, zum Beispiel in den Wurzeln von Heliotropium strigosum oder Eupatorium maculatum.[3]
Synthese
[Bearbeiten | Quelltext bearbeiten]Es gibt verschiedene Wege zur Synthese von Trachelanthamidin. Man kann von N-(4-Methoxyphenyl)-2-[(4-methylphenyl)sulfonyl]acetamid und Ethyl-(2Z)-4-(benzyloxy)-2-brom-2-butenoat ausgehen. Diese beiden Edukte werden zuerst anelliert und danach intramolekular cyclisiert. Man erhält ein Isomerengemisch.[4] Eine relativ simple Synthese erzeugt aus γ-Chlorbutyraldehyd und Triethylphosphonoacetat ein Produkt, welches mit Aziridin umgesetzt wird. Daraus kann mittels mehrerer Zwischenschritte Trachelanthamidin gewonnen werden.[5] Auch 4-Nitrobutanalethylenacetal, welches durch Reaktion von Acrolein, Nitromethan, Ethylenglycol und einem Katalysator erhalten werden kann, ist als Ausgangsprodukt geeignet.[3]
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ Sebastian Schramm, Nikolai Köhler and Wilfried Rozhon: Pyrrolizidine Alkaloids: Biosynthesis, Biological Activities and Occurrence in Crop Plants. 24. Februar 2019, doi:10.3390/molecules24030498, PMID 30704105, PMC 6385001 (freier Volltext).
- ↑ a b Albert Horni, Ivana Hubáček, Manfred Hesse: Synthese des Pyrrolizidin-Alkaloides (±)-Trachelanthamidin. In: Helvetica Chimica Acta. Band 77, Nr. 2, 23. März 1994, S. 579–585, doi:10.1002/hlca.19940770221.
- ↑ Ru-Ting Hsu, Nein-Chen Chang, Meng-Yang Chang: Formal Synthesis of (±)-Trachelanthamidine via Base-Induced Formal [3+2] Annulation and Intramolecular Cyclization. In: Journal of the Chinese Chemical Society. Band 53, Nr. 4, 2006, S. 945–954, doi:10.1002/jccs.200600126.
- ↑ Tetsuji Kametani, Kimio Higashiyama, Hirotaka Otomasu, Toshio Honda: Application of Aziridine to the Facile Synthesis of (±)-Supinidine and (±)-Trachelanthamidine. In: Israel Journal of Chemistry. Band 27, Nr. 1, 1986, S. 57–59, doi:10.1002/ijch.198600010.