Brookers Merocyanin
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
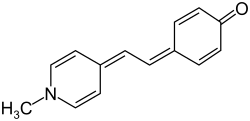
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Brookers Merocyanin | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C14H13NO | ||||||||||||||||||
| Kurzbeschreibung |
roter Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 211,26 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Brookers Merocyanin (auch MOED als Abkürzung der Bezeichnung 1-Methyl-4-[(oxocyclohexadienyliden)ethyliden]-1,4-dihydropyridin) ist ein Farbstoff, dessen Farbe in Lösung vom Lösungsmittel abhängt.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Brookers Merocyanin wurde 1951 von Leslie G. S. Brooker entwickelt.[4] MOED besitzt solvatochrome Eigenschaften, d. h., es ändert je nach umgebendem Lösungsmittel oder pH-Wert sein Absorptionsspektrum und sein Fluoreszenz-Emissionsspektrum.[5][6]

MOED kann in zwei Resonanzstrukturen vorliegen, als neutrales Molekül und als Zwitterion. In polarer Umgebung dominiert die gelbe zwitterionische Form, während in Chloroform oder Aceton das blaue neutrale Molekül vorherrscht.[7][8] Je polarer das Lösungsmittel, desto kleiner ist die Frequenz bzw. desto größer die Wellenlänge.

Synthese
[Bearbeiten | Quelltext bearbeiten]Durch Methylierung von 4-Methylpyridin mit Methyliodid entsteht 1,4-Dimethylpyridiniumiodid. Dessen Reaktion mit 4-Hydroxybenzaldehyd und anschließende Zugabe wässriger Base erzeugt MOED.

Anwendungen
[Bearbeiten | Quelltext bearbeiten]Aufgrund der solvatochromen Eigenschaften wird MOED, wie auch der Reichardt-Farbstoff, als Indikator für die Polarität einer Lösung verwendet. Weiterhin können bei Lösungen durch Veränderung der Lösungsmittelkonzentrationen definierte Farben eingestellt werden. Weitere Verwendungen werden untersucht.[9] MOED ändert seine Farbe und seine Fluoreszenz bei einer Bindung an DNA und kann zur Bestimmung der Konzentration gereinigter DNA-Lösungen verwendet werden.[6]
Literatur
[Bearbeiten | Quelltext bearbeiten]- M J Minch and S Sadiq Shah: Spectroscopic studies of hydrophobic association. Merocyanine dyes in cationic and anionic micelles. Journal of Organic Chemistry, 44:3252, 1979.
- Amaresh Mishra, et al.: Cyanines during the 1990s: A Review, Chemical Reviews, 2000, 100 (6), 1973–2012. doi:10.1021/cr990402t
- Christian Reichardt: Solvatochromic Dyes as Solvent Polarity Indicators, Chem. Rev., 1994, 94 (8), 2319–2358. doi:10.1021/cr00032a005
- S. J. Davidson and W. P. Jencks: The Effect of Concentrated Salt Solutions on a Merocyanine Dye, a Vinylogous Amide, Journal of the American Chemical Society, 1969, 91 (2), 225–234. doi:10.1021/ja01030a001
- Brooker, Keyes, et al.: Studies in the Cyanine Dye Series. XI. The Merocyanines, J. Am. Chem. Soc., 1951, 73 (11), 5326–5332. doi:10.1021/ja01155a095
- Brooker, Keyes, et al.: Color and Constitution. XI.1 Anhydronium Bases of p-Hydroxystyryl Dyes as Solvent Polarity Indicators, J. Am. Chem. Soc., 1951, 73 (11), 5350–5356. doi:10.1021/ja01155a097
- Mohamed K. Awad and Shakir T. Abdel-Halim: Mechanism of Water Attacking on Brooker’s Merocyanine Dye and Its Effect on the Molecular and Electronic Structures: Theoretical Study, Bull. Chem. Soc. Jpn. Vol. 79, No. 6, 838–844 (2006)
- H.S. Freeman and S.A. McIntosh, Some Interesting Substituent Effects in Merocyanine Dyes, Educ. in Chem., 27(3) 79(1990).
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Siegfried Hünig, Othmar Rosenthal: Farbe und Konstitution II: Phenolbetainfarbstoffe. In: Justus Liebigs Annalen der Chemie. Band 592, Nr. 3, 19. April 1955, S. 161–179, doi:10.1002/jlac.19555920302.
- ↑ Samuel James Davidson, William P. Jencks: Effect of concentrated salt solutions on a merocyanine dye, a vinylogous amide. In: Journal of the American Chemical Society. Band 91, Nr. 2, Januar 1969, S. 225–234, doi:10.1021/ja01030a001.
- ↑ Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- ↑ L. G. S. Brooker, G. H. Keyes, R. H. Sprague, R. H. VanDyke, E. VanLare, G. VanZandt, F. L. White: Studies in the Cyanine Dye Series. XI. The Merocyanines. In: Journal of the American Chemical Society. 73, 1951, S. 5326–5332, doi:10.1021/ja01155a095.
- ↑ V. Cavalli, D. C. da Silva, C. Machado, V. G. Machado, V. Soldi: The fluorosolvatochromism of Brooker's merocyanine in pure and in mixed solvents. In: Journal of Fluorescence. Band 16, Nummer 1, Januar 2006, S. 77–86, doi:10.1007/s10895-005-0053-9. PMID 16496216.
- ↑ a b H. Kashida, K. Sano, Y. Hara, H. Asanuma: Modulation of pK(a) of Brooker's merocyanine by DNA hybridization. In: Bioconjugate Chemistry. Band 20, Nummer 2, Februar 2009, S. 258–265, doi:10.1021/bc800335h. PMID 19170520.
- ↑ "Fundamental Studies on Brooker’s Merocyanine", Morley et al., J. Am. Chem. Soc., 1997, 119 (42), 10192-10202, doi:10.1021/ja971477m
- ↑ N. A. Murugan, J. Kongsted, Z. Rinkevicius, H. Agren: Demystifying the solvatochromic reversal in Brooker's merocyanine dye. In: Physical chemistry chemical physics : PCCP. Band 13, Nummer 4, Januar 2011, S. 1290–1292, doi:10.1039/c0cp01014f. PMID 21132167.
- ↑ Valerii Z. Shirinian and Alexey A. Shimkin: Merocyanines: Synthesis and Application, in Topics in Heterocyclic Chemistry, Springer, 2008.