Natriumselenit
Natriumselenit ist das Natriumsalz der Selenigen Säure (H2SeO3) mit der chemischen Formel Na2SeO3. Es liegt in Form nadelförmiger, weißer, hygroskopischer Kristalle vor.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
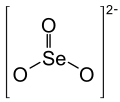
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Natriumselenit | ||||||||||||||||||
| Andere Namen | |||||||||||||||||||
| Summenformel | Na2SeO3 | ||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchloses, feuchtigkeitsempfindliches Pulver[2] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 172,94 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest[2] | ||||||||||||||||||
| Dichte |
3,4 g·cm−3[3] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (950 g·l−1 bei 20 °C)[2] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| MAK |
0,02 mg·m−3 (gemessen als einatembarer Aerosolanteil)[2] | ||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
Vorkommen
BearbeitenNatriumselenit kommt natürlich in tierischem Gewebe vor.[6]
Gewinnung und Darstellung
BearbeitenDas Salz lässt sich durch Auflösen von Selendioxid in Natronlauge gewinnen, wobei die durch Reaktion des Selendioxids mit Wasser entstehende Selenige Säure mit dem Natriumhydroxid zu Natriumselenit reagiert:[7]
Nettoreaktion:
Eigenschaften
BearbeitenPhysikalische Eigenschaften
BearbeitenNatriumselenit ist ein farb- und geruchloser, feuchtigkeitsempfindlicher Feststoff.[2] Er hat eine monokline Kristallstruktur mit der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3).[3]
Die Standardbildungsenthalpie für festes Natriumselenit liegt bei −959 kJ/mol für das wasserfreie Salz bzw. bei −2404 kJ/mol für das Pentahydrat.[8]
Das Selenit-Ion ist pyramidal mit C3v-Symmetrie aufgebaut, der Abstand zwischen Sauerstoff- und Selenatom beträgt 1,74 Å.
Bei ca. 40 °C gibt das Pentahydrat sein Kristallwasser ab.
Chemische Eigenschaften
BearbeitenAus Natriumselenit wird durch Reduktionsmittel wie Ascorbinsäure[9] sehr leicht rotes amorphes Selen abgespaltet.
Verwendung
BearbeitenTechnisch
BearbeitenNatriumselenit wird zur Rotfärbung von Glas und Porzellan (Reduktion zu rotem Selen), als Bestandteil von Fixierbädern und zur Prüfung der Keimfähigkeit von Saatgut verwendet. In Schweden wird in Kunststoff eingebettetes Natriumselenit zur Fällung von Quecksilberionen als unlösliches Quecksilberselenid in Seen verwendet.
Des Weiteren dient es als Nachweisreagenz für Alkaloide.
Gesundheitsbezogen
BearbeitenMedizinisch wird Natriumselenit (auch als Natriumselenit-Pentahydrat[10]) gegeben bei einem Selenmangel, der nicht durch Ernährung ausgeglichen werden kann, etwa bei Verdauungs- und Verwertungsstörungen, oder bei einer langfristig fehlender Selenzufuhr (was insbesondere Regionen in Höhenlagen Zentralafrikas und Asiens betrifft) oder bei Mutationen in Genen, die den Selenstoffwechsel und damit die Selenoproteinsynthese beeinträchtigen.[11]
Außerdem wird es zur Behandlung von der Keshan-Krankheit eingesetzt.[11] Weiterhin gibt es Studien die eine Unterstützung bei der Prävention von Krankheiten wie Hashimoto-Thyreoiditis nahelegen.[12]
Als Nahrungsergänzungsmittel wird Selen[11] beispielsweise zur Unterstützung des Immunsystems, zur Unterstützung der normalen Schilddrüsenfunktion, zur Erhaltung normaler Haare und Nägel sowie zum Schutz der Zellen vor oxidativem Stress verwendet.[13][14] Eine unzureichende Selenzufuhr, die normale Haare und Nägel beeinträchtigt, ist für die EU-Bevölkerung – in Anbetracht der der Europäischen Behörde für Lebensmittelsicherheit (EFSA) vorgelegten Daten – nicht belegt.[13] Auch als Zusatzstoff in der Tierernährung kann Natriumselenit eingesetzt werden.[11]
Siehe auch
Bearbeiten- Natriumselenid Na2Se
- Natriumselenat Na2SeO4
Literatur
Bearbeiten- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 101. Auflage. Walter de Gruyter, Berlin 1995, ISBN 3-11-012641-9.
- Autorenkollektiv: Anorganikum. 5. Auflage. VEB Deutscher Verlag der Wissenschaften Berlin 1973.
- Eintrag zu Natriumselenit. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
Einzelnachweise
Bearbeiten- ↑ Eintrag zu DISODIUM SELENITE in der CosIng-Datenbank der EU-Kommission, abgerufen am 17. September 2021.
- ↑ a b c d e f g h Eintrag zu Natriumselenit in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ a b Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. Springer DE, 1997, ISBN 3-540-60035-3, S. 626 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ Eintrag zu Sodium selenite im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ Datenblatt Sodium selenite bei Fisher Scientific, abgerufen am 13. Februar 2014 (PDF).
- ↑ MeriMed: Natriumselenit ( vom 29. Juni 2008 im Internet Archive)
- ↑ G. Brauer (Hrsg.), Handbook of Preparative Inorganic Chemistry 2nd ed., vol. 1, Academic Press 1963, S. 431–432.
- ↑ G.H. Aylward, T.J.V. Findlay: Datensammlung Chemie in SI-Einheiten. 3. Auflage. Wiley-VCH, 1999, ISBN 3-527-29468-6.
- ↑ Daniela Štefanková, Kryštof Skrbek, Martin Pižl, Vilém Bartůněk: Nano and mesosized selenium and its synthesis using the ascorbic acid route. In: Journal of Non-Crystalline Solids. Band 616, September 2023, S. 122462, doi:10.1016/j.jnoncrysol.2023.122462 (elsevier.com [abgerufen am 16. April 2024]).
- ↑ Externe Identifikatoren von bzw. Datenbank-Links zu Natriumselenit-Pentahydrat: CAS-Nr.: 26970-82-1, EG-Nr.: 641-389-2, ECHA-InfoCard: 100.169.207, PubChem: 134930, ChemSpider: 118907, Wikidata: Q27225115.
- ↑ a b c d DGE: Ausgewählte Fragen und Antworten zu Selen, abgerufen am 14. August 2022.
- ↑ Qian Wu, Margaret P. Rayman, Hongjun Lv, Lutz Schomburg, Bo Cui, Chuqi Gao, Pu Chen, Guihua Zhuang, Zhenan Zhang, Xiaogang Peng, Hua Li, Yang Zhao, Xiaohong He, Gaoyuan Zeng, Fei Qin, Peng Hou, Bingying Shi: Low Population Selenium Status Is Associated With Increased Prevalence of Thyroid Disease. In: The Journal of Clinical Endocrinology and Metabolism. 2015, Band 100, Nummer 11, S. 4037–4047 doi:10.1210/jc.2015-2222.
- ↑ a b Scientific Opinion on the substantiation of health claims related to selenium and maintenance of normal hair (ID 281), maintenance of normal nails (ID 281), protection against heavy metals (ID 383), maintenance of normal joints (ID 409), maintenance of normal thyroid function (ID 410, 1292), protection of DNA, proteins and lipids from oxidative damage (ID 410, 1292), and maintenance of the normal function of the immune system (ID 1750) pursuant to Article 13(1) of Regulation (EC) No 1924/2006, EFSA, 9. Juli 2010.
- ↑ Scientific Opinion on the substantiation of health claims related to selenium and protection of DNA, proteins and lipids from oxidative damage (ID 277, 283, 286, 1289, 1290, 1291, 1293, 1751), function of the immune system (ID 278), thyroid function (ID 279, 282, 286, 1289, 1290, 1291, 1293), function of the heart and blood vessels (ID 280), prostate function (ID 284), cognitive function (ID 285) and spermatogenesis (ID 396) pursuant to Article 13(1) of Regulation (EC) No 1924/2006, EFSA, 2. Juli 2009.

