Diphosphate
Diphosphate (auch Pyrophosphate, Abkürzungen PPa und engl. PPi) sind Salze und Ester der Diphosphorsäure H4P2O7. Diphosphate sind Kondensate von zwei Phosphaten. Sie sind über eine P–O–P-Säureanhydrid-Bindung miteinander verknüpft (Konstitutionsformel [(O3P)–O–(PO3)]4−). Die Ester dieser Verbindungen verfügen zusätzlich über eine C–O–P-Bindung und haben die allgemeine Konstitutionsformel R–O–[(PO2)–O–(PO3)]3− (R: organischer Rest).
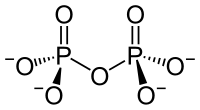
Salze der Diphosphorsäure
Bearbeiten| Salze der Diphosphorsäure | ||
|---|---|---|
| Name | Formel | andere Bezeichnung |
| Dinatriumdihydrogendiphosphat | Na2H2P2O7 | E 450a |
| Trinatriumhydrogendiphosphat | Na3HP2O7 | E 450b |
| Tetranatriumdiphosphat | Na4P2O7 | E 450c |
| Weitere Beispiele siehe Kategorie:Phosphat | ||
Synthese
BearbeitenGlüht man sekundäre Phosphate, wird unter Wasserabspaltung Diphosphat gebildet:
Lebensmittelchemie
BearbeitenDiphosphate kommen in der Lebensmittelchemie unter anderem als Emulgatoren vor, haben jedoch eine Reihe weiterer Eigenschaften und können etwa auch als Konservierungs-, Antioxidations-, Trenn- und Backtriebmittel, Komplexbildner, Säureregulatoren und Schmelzsalze fungieren. Diese künstlich hergestellte Emulgatorklasse bindet Wasser, verhindert Verklumpen pulverförmiger Lebensmittel und führt in Verbindung mit Calcium zu einer cremigen Konsistenz. Da Phosphate im Verdacht stehen allergische Reaktionen und Osteoporose auszulösen, sollte bei der Einnahme von Phosphaten stets auf die richtige Dosierung geachtet werden. Es wurde eine erlaubte Tagesdosis von 70 Milligramm pro Kilogramm Körpergewicht für die Gesamtmenge aufgenommener Phosphorsäure und Phosphate insgesamt festgelegt. In der EU sind Diphosphate (Dinatrium-, Tri-natrium-, Tetranatrium-, Tetrakalium-, Dicalcium- und Calciumdihydrogen-Diphosphat) als Lebensmittelzusatzstoff der Nummer E 450 für bestimmte Lebensmittel mit jeweils unterschiedlichen Höchstmengenbeschränkungen zugelassen. Nach der Zusatzstoff-Zulassungsverordnung sind dies – für die meisten zugelassenen Phosphate weitgehend einheitliche – einzelne Festlegungen für eine breite Palette mit zahlreichen unterschiedlichen Lebensmittelsorten. Die zugelassenen Höchstmengen variieren von 0,5 bis hin zu 50 Gramm pro Kilogramm (in Getränkeweißer für Automaten) oder auch dem Fehlen einer festen Beschränkung (quantum satis – nach Bedarf, bei Nahrungsergänzungsmitteln und teils bei Kaugummis).
Ester der Diphosphorsäure
BearbeitenDiphosphorsäureester spielen eine erhebliche Rolle in der Biochemie (siehe unten). Als anthropogene Xenobiotika spielen sie eine eher geringe Rolle.
Eine gewisse Bedeutung hat der Tetraethyl-Ester der Diphosphorsäure Tetraethylpyrophosphat (TEPP) als humantoxisches Nervengift und nicht zugelassenes Insektizid erlangt.[1]
Biochemische Bedeutung
BearbeitenDiphosphate können wie alle Phosphorsäureanhydride Phosphat-Gruppen auf nukleophilen Moleküle wie Wasser, Alkohole und anderen Verbindungen mit OH-Gruppen exergon übertragen. Solche Phosphorylierungsreaktionen spielen eine ganz entscheidende Rolle bei allen biochemischen Prozessen, bei denen Energie übertragen wird. Eine entscheidende Rolle spielt dabei ATP.
Diphosphat kann ebenso wie Polyphosphat spontan bei geochemischen Prozessen entstehen. Als im späten Hadaikum bei der Chemischen Evolution komplexe organische Moleküle entstanden sind, könnte dabei Diphosphat die Rolle des Energieüberträgers gespielt haben, die heute ATP spielt.[2][3]
Im menschlichen Stoffwechsel sind Salze der Diphosphorsäure („anorganisches Pyrophosphat“) eher Abfallprodukte, die wiederverwertet werden müssen. Kalziumpyrophosphat-Kristalle sind bei der Pseudogicht (Kristallarthropathie) an einer schmerzhaften Erkrankung der Gelenke beteiligt.
Organische Diphosphat-Derivate („organisches Pyrophosphat“) sind dagegen für alle bekannten Lebewesen unentbehrlich.
Organische Diphosphate
BearbeitenEster der Diphosphorsäure findet man in allen lebenden Organismen. Sie sind Grundbausteine einer Vielzahl komplexer Naturstoffe. Für deren Biosynthese liefern die energiereichen Pyrophosphatgruppen einen Teil der dabei nötigen Energie. Dimethylallylpyrophosphat (Dimethyl-Allyl-PP) ist zusammen mit Isopentenylpyrophosphat Ausgangsstoff der Cholesterinbiosynthese und der Biosynthese von bisher 30.000 bekannten Terpenen und Terpenoiden.
- Diphosphate als Coenzyme
Eine Reihe von Coenzymen (vgl. Abbildung rechts), die für alle Organismen lebenswichtig sind und durchweg im Stoffwechsel produziert werden, gehören zu den organischen Diphosphaten. (Beim Menschen muss das Diphosphat Riboflavin, Vitamin B2 mit der Nahrung aufgenommen werden.)
Beim Coenzym ADP (Adenosindiphosphat) spielt die Diphosphat-Gruppe eine wesentliche Rolle bei Energieübertragungsprozessen in lebenden Zellen. ADP ist Co-Substrat nahezu aller Enzyme, mit denen ATP unter Energieaufwand (ΔH = 50 kJ/mol unter physiologischen Bedingungen) regeneriert wird. Das geschieht vor allem mittels der ATP-Synthase nach der Reaktionsgleichung
- ADP + Phosphat + H+außen → ATP + H2O + H+innen.
nach dem Prinzip der Chemiosmose. Bei der Substratkettenphosphorylierung ist ADP ebenfalls Reaktionspartner, so z. B. bei der Phosphoglyceratkinase, die folgende Reaktion katalysiert:
Bei der Rückreaktion dieser Gleichung, die bei der Biosynthese von Zuckern wichtig ist, wird umgekehrt ADP gebildet. Eine ganze Reihe endergoner Reaktionen werden im Stoffwechsel nach diesem Prinzip
- ATP + H2O → ADP + Phosphat
ermöglicht, bei dem ein Gruppenübertragungspotenzial ΔG0’ = −30,5 [kJ·mol−1] die Energie liefert.[4]
Anorganische Diphosphate
BearbeitenDiphosphat als Abfallprodukt anaboler Prozesse
BearbeitenATP wird zudem bei Prozessen verbraucht, bei denen nicht etwa organisches Adenosindiphosphat, sondern anorganisches Diphosphat (abgekürzt: PPi) gebildet wird. Summarisch geschieht das nach
- ATP + H2O → AMP + PPi (Diphosphat)
mit einem Gruppenübertragungspotenzial ΔG0’ = −57 [kJ·mol−1][4]
Im Stoffwechsel entsteht Diphosphat durchweg bei anabolen, zum Aufbau von Biomasse dienenden Reaktionen.[2] Von ca. 200 PPi produzierenden Reaktionen[5] dienen ca.
- 7% der Produktion von Molekülen, die zur Stoffwechselregulation dienen, wie z. B. der Adenylylcyclasen katalysierten Bildung von Cyclo-AMP.
- Rund 20% entstehen bei der Synthese von Fettsäuren, aber auch deren Abbau (α-Oxidation und β-Oxidation).
- 29% des entstehenden PPi wird bei der Biosynthese von kleinen meist essentiellen Biomolekülen frei.
- Dazu gehört auch die Bildung von "aktivierter Schwefelsäure" beim ersten Schritt der Desulfurikation und der Schwefel Assimilation in Pflanzen.
- Auch die Synthese von NAD, die nach
- ATP + NMN ⇌ NAD + PPi
- durch die Nicotinamidnukleotid-Adenylyltransferase katalysiert wird, setzt Diphosphat frei. Zwar kann im Prinzip die Umkehrung dieser Reaktion (NAD + PPi ⇌ ATP + NMN) auch Diphosphat zur ATP-Bildung verwenden[6]. Doch unter physiologischen Bedingungen kann die Spaltung eines derartig wichtigen Coenzyms wie NAD keine relevante Reaktion zur Bildung von ATP sein. Tatsächlich wird in vivo NAD durch eine Nukleotid-Diphosphatase (siehe auch Organische_Diphosphatasen) hydrolytisch abgebaut, und die Rückreaktion der Adenylyltransferase muss vermieden werden.
- Ca. 35% des Diphosphats stammen aus der Synthese und Modifikation von Makromolekülen. Prinzipiell setzen alle Synthesen von biologischen Makromolekülen[7] Diphosphat frei.
- Biosynthese von Nukleinsäuren, z. B. mittels der RNA-Polymerase II, die auch aus anderen Nukleotid-Triphosphaten PPi freisetzt (Transkription):
+ + - Auch die DNA-Replikation setzt bei jedem Schritt anorganisches Diphosphat frei.
- Die Bildung "aktivierter Aminosäuren" durch jeweilige Aminoacyl-tRNA-Synthetasen als erster Schritt der Proteinbiosynthese liefert bei den meisten Organismen das meiste PPi:
- Biosynthese von Nukleinsäuren, z. B. mittels der RNA-Polymerase II, die auch aus anderen Nukleotid-Triphosphaten PPi freisetzt (Transkription):
Die Abspaltung des Diphosphats setzt Energie frei, da das entstehende freie Diphosphat durch Mesomerie und Hydratation einerseits stabilisiert wird. Andererseits kommt auch ein entropischer Effekt zum Tragen, da sich die Entropie des Systems erhöht hat. Diese Energie wird häufig genutzt, um eine an diesen Vorgang gekoppelte, für sich allein genommen endergone Reaktion zu ermöglichen. Häufig werden Diphosphate durch Pyrophosphatasen in zwei Phosphate gespalten. Das verschiebt die jeweiligen Reaktionsgleichgewichte noch mehr auf die rechte Seite, was die jeweiligen Reaktionen irreversibel macht, weil die Pyrophosphatase ein Endprodukt aus dem Gleichgewicht beseitigt.
Nutzung von Diphosphat im Stoffwechsel
BearbeitenEs wird auch diskutiert, ob neben ATP auch Diphosphate als alternative Energiedonatoren in Bakterien und Pflanzen genutzt werden können.[8][9]
Im tierischen Stoffwechsel und im Stoffwechsel vieler Mikroorganismen wird Diphosphat zügig durch im Cytosol gelöste Pyrophosphatasen zu Phosphat recycelt und die freiwerdende Energie wird als Wärme frei.
Außer bei vielzelligen Tieren und Pilzen wird Diphosphat aber auch energetisch verwertet. Das geschieht durch unlösliche, in Biomembrane integrierte Pyrophosphatasen, die als chemiosmotisch aktive Protonenpumpen fungieren. Diese Enzyme sind sehr alt und gehen auf einen gemeinsam Stammbaum zurück. Außer bei vielen Prokaryoten und tierischen Einzellern[2] spielen sie bei Landpflanzen eine wichtige Rolle. Sie finden sich dort gehäuft in den Membranen von Vakuolen und dienen dort als H+-Pumpe. Dabei sparen sie ATP ein, das ansonsten durch ATP-spaltende H+-Pumpen verbraucht werden müsste. In Pflanzen-Mitochondrien kann Diphosphat durch die dort spezifische Diphosphat spaltende Aktivität der ATP-Synthase ohne Energiekonservierung gespalten werden.
Im Zellplasma vieler Pflanzen finden sich keine löslichen, Energie verschwendenden Pyrophosphatasen, und so nimmt die Diphosphat-Konzentration im Cytosol Werte von 0,2–0,3 mM an. Diphosphat verwertende Prozesse sind bei Pflanzen weit verbreitet und kommen parallel zu ATP-verbrauchenden Stoffwechselwegen vor.[10] Als ATP ersetzender Energieüberträger kann Pyrophosphat zum Beispiel bei der Glycolyse dienen, wo eine Pyrophosphate: Fructose-6-phosphate Phosphotransferase die Phosphofructokinasen ersetzt.[11][12]
Weblinks
Bearbeiten- zusatzstoffe-online.de: E 450 - Diphosphate
Einzelnachweise
Bearbeiten- ↑ L. Szinicz: History of chemical and biological warfare agents. In: Toxicology. Band 214, Nr. 3, 2005, S. 173, doi:10.1016/j.tox.2005.06.011 (online).
- ↑ a b c Alexander A. Baykov, Anssi M. Malinen, Heidi H. Luoto, Reijo Lahti: Pyrophosphate-Fueled Na+ and H+ Transport in Prokaryotes. In: Microbiol. Mol. Biol. Rev. Band 77, Nr. 2, 2013, S. 267–276, doi:10.1128/MMBR.00003-13 (online [PDF]).
- ↑ Nils G. Holm, Herrick Baltscheffsky: Links between hydrothermal environments, pyrophosphate, Na+, and early evolution. In: Origins of Life and Evolution of Biospheres. Band 41, Nr. 5, 2011, S. 483–493, doi:10.1007/s11084-011-9235-4.
- ↑ a b Lubert Stryer: Biochemistry. 5. Auflage. W.H. Freeman and Company, New York 2002, ISBN 0-7167-1843-X., zitiert nach en:Adenosine triphosphate
- ↑ Jukka K. Heinonen: Biological role of inorganic pyrophosphate. Springer Science & Business Media (vormals Kluwer Academic Publ), Berlin 2001.
- ↑ Arthur Kornberg: The participation of inorganic pyrophosphate in the reversible enzymatic synthesis of diphosphopyridine nucleotide. In: Journal of Biological Chemistry. Band 176, Nr. 3, 1948, S. 1475–1476.
- ↑ Jukka K. Heinonen: Biological role of inorganic pyrophosphate. Springer Science & Business Media (vormals Kluwer Academic Publ), Berlin 2001, S. 11.
- ↑ A. Serrano u. a.: H+-PPases: yesterday, today and tomorrow. In: IUBMB Life. 59(2), 2007, S. 76–83. PMID 17454298.
- ↑ M. Baltscheffsky: Inorganic pyrophosphate as an energy donor in photosynthetic and respiratory electron transport phosphorylation systems. In: Biochem Biophys Res Commun. 28(2), 1967, S. 270–276. PMID 4291991.
- ↑ Marco Zancani, Valentino Casolo, Carlo Peresson, Giorgio Federici, Andrea Urbani, Francesco Macrı̀, Angelo Vianello: The β-subunit of pea stem mitochondrial ATP synthase exhibits PPiase activity. In: Mitochondrion. Band 3, Nr. 2, 2003, S. 111–118, doi:10.1016/S1567-7249(03)00105-3 (online [PDF]).
- ↑ M. Stitt: Pyrophosphate as an alternative energy donor in the cytosol of plant cells: an enigmatic alternative to ATP. In: Bot. Acta. Band 111, 1998, S. 167–175.
- ↑ Yoko Chiba, Ryoma Kamikawa, Kumiko Nakada-Tsukui, Yumikoco Saito-Nakano, Tomoyoshi Nozaki: Discovery of PPi-type Phosphoenolpyruvate Carboxykinase Genes in Eukaryotes and Bacteria. In: Journal of Biological Chemistry. Band 290, Nr. 39, 2015, S. 23960–23970, doi:10.1074/jbc.M115.672907 (Abstract).