Amprenavir
Amprenavir ist ein Arzneistoff aus der Gruppe der HIV-Proteaseinhibitoren zur oralen Therapie von HIV-1-Infektionen. 2011 erlosch seine Zulassung in der EU auf Wunsch des Zulassungsinhabers.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
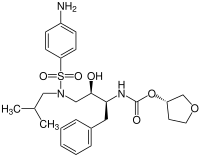
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Amprenavir | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C25H35N3O6S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
Hemmung der HIV-Protease | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 505,63 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Geschichte
BearbeitenAmprenavir wurde von Vertex Pharmaceuticals entwickelt und 1995 als neuer antiviraler Wirkstoff der Öffentlichkeit präsentiert. Die Zulassung für die USA erfolgte im April 1999, in der EU im Oktober 2000.[2][3]
Amprenavir wurde in der EU bis Ende 2008 als Agenerase vermarktet, die EU-Zulassung erlosch 2011 durch Rücknahme durch den Zulassungsinhaber GlaxoSmithKline.[4]
Indikation
BearbeitenAmprenavir ist, so wie die übrigen Wirkstoffe aus der Gruppe der HIV-Proteaseinhibitoren, in Kombinationen mit anderen Virustatika zur Therapie einer Infektion durch HIV-1 bei Erwachsenen und Kindern über vier Jahren anwendbar. Verschiedene Kombinationen zeigten bei etwa der Hälfte der Patienten einen deutlichen Rückgang der Viruslast.[5]
Wirkungsmechanismus
BearbeitenAmprenavir hemmt die virale Protease von HIV-1 (HIV-Protease). Dieses Enzym spielt eine maßgebliche Rolle bei der Bildung neuer infektiöser Viruspartikel. Somit kann durch Hemmung der Protease letztlich die Virusausbreitung im menschlichen Körper eingeschränkt werden. Im Gegensatz zu älteren Vertretern derselben Gruppe dürfte der Bindungsmechanismus zwischen Enzym und Wirkstoff andersartig sein. Dies lässt sich aus der Tatsache schließen, dass bei Patienten, die resistent gegen einen älteren HIV-Proteaseinhibitor reagierten, keine Kreuzresistenz gegen Amprenavir auftrat.[6]
In der klinischen Testphase wurde die Wirksamkeit von Amprenavir mit der des erprobten Arzneistoffes Indinavir verglichen. Dabei erschien Amprenavir als weniger wirksam und weniger nachhaltig als das Vergleichsmittel.[6]
Pharmakologie
BearbeitenAmprenavir wird nach oraler Gabe rasch und fast vollständig im Magen-Darm-Trakt resorbiert. Eine gleichzeitige Nahrungsaufnahme kann geringfügige Auswirkungen auf die Resorption haben. Die Eliminationshalbwertzeit beträgt ca. 10 Stunden. Folglich reicht es, das Medikament zweimal täglich, bei einer Einzeldosis von 1200 mg, einzunehmen. Im Blut wird der Wirkstoff zu etwa 90 % an Plasmaproteine gebunden und in der Leber beinahe vollständig metabolisiert.[6]
Nebenwirkungen und Kontraindikationen
BearbeitenUnerwünschte Wirkungen, die man beobachtet, betreffen hauptsächlich den Gastrointestinaltrakt. Wie bei anderen HIV-Proteaseinhibitoren treten Durchfall und Bauchschmerzen auf. Weiter kommt es zu Parästhesien und Hautreaktionen. Makulopapulöse Hautausschläge traten in klinischen Studien bei bis zu einem Drittel der Patienten auf, wobei es relativ oft (bei 1 % der Behandelten) zu lebensbedrohlichen Komplikationen, etwa dem Stevens-Johnson-Syndrom kam, worauf die Therapie abgebrochen werden musste. Auch metabolische Störungen, einschließlich Fettumverteilungsphänomene, wurden unter Amprenavir beobachtet. Allerdings scheint dies weniger häufig der Fall zu sein, als bei Therapie mit Indinavir. Amprenavir gehört aufgrund seiner chemischen Struktur zu den Sulfonamiden. Dies kann in bestimmten Fällen zu Überempfindlichkeitsreaktionen führen.[6]
Der Abbaumechanismus von Amprenavir durch die Leber (hauptsächlich CYP3A4) hat zahlreiche Arzneimittelwechselwirkungen mit anderen Arzneistoffen zur Folge. Vor allem lipophile, ZNS-wirksame Medikamente, wie zum Beispiel Benzodiazepine oder Antidepressiva, aber auch Antihistaminika und Antiarrhythmika, können gemeinsam mit Amprenavir schwerwiegende Folgewirkungen verursachen. Auch bei Induktoren des Cytochrom-P450-Systems, wie beispielsweise Johanniskraut-Extrakten, ist Vorsicht geboten, da solche den Amprenavir-Spiegel im Blut senken.[5]
Sonstige Informationen
BearbeitenAmprenavir ist der wirksame Metabolit von Fosamprenavir.
Weiterführende Literatur
Bearbeiten- Wensing AM, van Maarseveen NM, Nijhuis M: Fifteen years of HIV Protease Inhibitors: raising the barrier to resistance. In: Antiviral Res. Oktober 2009, doi:10.1016/j.antiviral.2009.10.003, PMID 19853627.
- Kovalevsky AY, Ghosh AK, Weber IT: Solution kinetics measurements suggest HIV-1 protease has two binding sites for darunavir and amprenavir. In: J Med Chem. 51. Jahrgang, Nr. 20, Oktober 2008, S. 6599–603, doi:10.1021/jm800283k, PMID 18808097, PMC 2771923 (freier Volltext).
Einzelnachweise
Bearbeiten- ↑ a b Datenblatt Amprenavir bei Sigma-Aldrich, abgerufen am 3. Januar 2023 (PDF).
- ↑ https://ec.europa.eu/health/documents/community-register/html/h148.htm
- ↑ Wlodawer A, Vondrasek J: Inhibitors of HIV-1 protease: a major success of structure-assisted drug design. In: Annu Rev Biophys Biomol Struct. 27. Jahrgang, 1998, S. 249–84, doi:10.1146/annurev.biophys.27.1.249, PMID 9646869.
- ↑ Agenerase (amprenavir) - Withdrawal of the marketing authorisation in the European Union. (PDF) In: EMA. 6. Juni 2011, abgerufen am 29. Mai 2023 (englisch).
- ↑ a b Fung HB, Kirschenbaum HL, Hameed R: Amprenavir: a new human immunodeficiency virus type 1 protease inhibitor. In: Clin Ther. 22. Jahrgang, Nr. 5, Mai 2000, S. 549–72, doi:10.1016/S0149-2918(00)80044-2, PMID 10868554.
- ↑ a b c d Noble S, Goa KL: Amprenavir: a review of its clinical potential in patients with HIV infection. In: Drugs. 60. Jahrgang, Nr. 6, Dezember 2000, S. 1383–410, PMID 11152018.