Half-cell
Trong điện hóa học, half-cell là cấu trúc chứa điện cực dẫn điện và chất điện phân dẫn điện xung quanh được ngăn cách bởi lớp kép Helmholtz xuất hiện tự nhiên. Các phản ứng hóa học trong lớp này sẽ nhanh chóng bơm điện tích giữa điện cực và chất điện phân, dẫn đến sự chênh lệch điện thế giữa điện cực và chất điện phân. Phản ứng ở cực dương điển hình liên quan đến việc một nguyên tử kim loại trong điện cực bị hòa tan và vận chuyển dưới dạng ion dương qua lớp kép, làm cho chất điện phân thu được điện tích dương trong khi điện cực thu được điện tích âm. Sự chênh lệch điện thế ngày càng tăng tạo ra một điện trường cực mạnh bên trong lớp kép và điện thế tăng giá trị cho đến khi trường dừng các phản ứng bơm điện tích toàn phần. Hành động tự giới hạn này xảy ra gần như ngay lập tức trong một nửa ô bị cô lập; trong các ứng dụng, hai nửa ô khác nhau được kết nối một cách thích hợp để tạo thành một ô Galvanic.
Một half-cell tiêu chuẩn bao gồm một điện cực kim loại trong dung dịch nước 1 mol (1 mol/L) muối của kim loại, ở nhiệt độ 298 kelvin (25 °C).Chuỗi điện hóa, bao gồm các thế điện cực tiêu chuẩn và có liên quan chặt chẽ với chuỗi phản ứng, được tạo ra bằng cách đo sự chênh lệch điện thế giữa nửa tế bào kim loại trong mạch với half-cell hydro tiêu chuẩn, được nối với nhau bằng cầu muối.
Nửa tế bào hydro tiêu chuẩn:
2H+(aq) + 2e− → H2(g)
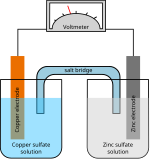
Các nửa ô của ô Daniell:
Phương trình gốc
Zn + Cu2+ → Zn2+ + Cu
Nửa cell (cực dương) của Zn:
Zn → Zn2+ + 2e−
Nửa tế bào (cực âm) của Cu:
Cu2 + 2e− → Cu