ไนเตรต
บทความนี้ไม่มีการอ้างอิงจากแหล่งที่มาใด |
| |
| ชื่อ | |
|---|---|
| Systematic IUPAC name
Nitrate | |
| เลขทะเบียน | |
3D model (JSmol)
|
|
| ChEBI | |
| เคมสไปเดอร์ | |
ผับเคม CID
|
|
| UNII | |
CompTox Dashboard (EPA)
|
|
| |
| |
| คุณสมบัติ | |
| NO− 3 | |
| มวลโมเลกุล | 62.004 g·mol−1 |
| กรด | Nitric acid |
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |
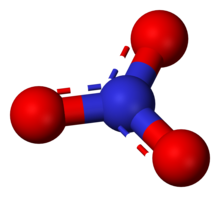
ไนเตรต ในทางอนินทรีย์เคมีเป็นเกลือของกรดไนตริก ไนเตรตไอออน เป็น พอลิอะตอมิกไอออน (polyatomic ion) ซึ่งมีสูตรเอมไพริกัล ดังนี้ NO3− และมีน้ำหนักโมเลกุลเท่ากับ 62.01 ดัลตัน (daltons) มันเป็นด่างร่วม (conjugate) ของกรดไนตริก ไนเตรตไอออนมีโครงสร้างเป็นสามเหลี่ยมแบนราบ (trigonal planar-โดยแต่ละออร์บิทัลทำมุมกัน 120 องศา) และสามารถแทนด้วยลูกผสม (hybrid) ดังรูปข้างล่างนี้

เกลือไนเตรตเกิดเมื่อไอออนประจุไฟฟ้าบวกเข้าเชื่อมต่อกับอะตอมของออกซิเจน ประจุไฟฟ้าลบตัวหนึ่งของไนเตรตไอออน
ประโยชน์ (Uses)
[แก้]ไนเตรต เช่น โพแทสเซียมไนเตรต (ซอลต์ปีเตอร์) และ แอมโมเนียมไนเตรต (ammonium nitrate) เป็นแหล่งสำคัญของ ไนโตรเจน ใน ปุ๋ย ไนเตรตจะต้องถูกใช้อย่างรวดเร็วโดยพืชเพราะมันจะสูญเสียง่ายจากการซึมชะละลาย (leaching) หรือกระบวนการเปลี่ยนไนเตรตเป็นไนโตรเจน (denitrification) โดยแบคทีเรียมลพิษของไนเตรตได้กลายไปเป็นปัญหาสิ่งแวดล้อม (environmentalism issue) ในแม่น้ำและ มหาสมุทร ตัวอย่างแม่น้ำที่มีระดับไนเตรตสูงติดอันดับโลกได้แก่
- เคาน์ตีแบล็กฮอก (Black Hawk County) ในรัฐไอโอวา กรีนพาร์ตี (Green Party)
- แม่น้ำซีดาร์ (รัฐไอโอวา)
ไนเตรตเป็นออกซิไดซิ่งเอเจนต์ที่ดี เมื่อผสมกับไฮโดรคาร์บอน หรือคาร์โบไฮเดรต ไนเตรตสามารถทำให้ส่วนผสมเกิดเปลวไฟหรือระเบิดได้ ตัวอย่างเช่นโพแทสเซียมไนเตรตเป็นออกซิไดซิ่งในดินปืน
ในทางการแพทย์ไนเตรตอินทรีย์ เช่น ไนโตรกลีเซอรีน (nitroglycerin) ไอโซซอร์ไบด์โมโนไนเตรต (ISMN) และ ไอโซซอร์ไบด์ไดไนเตรต (ISDN) ใช้ประโยชน์เฉพาะในการป้องกันและรักษาอาการปวดเค้นหัวใจ (angina pectoris) แต่อย่างไรก็ดีมันก็อาจเกิดปฏิกิริยาผลข้างเคียงได้หากรับประทานหลังใช้ยาซิลเดนาฟิลซิเตรต (sildenafil citrate-Viagra) หรือยาประเภทเดียวกันในระยะเวลา 24 ชั่วโมง
แหล่งข้อมูลอื่น
[แก้]- Case Studies in Environmental Medicine - Nitrate/Nitrite Toxicity เก็บถาวร 2006-01-01 ที่ เวย์แบ็กแมชชีน
- Computational Chemistry Wiki เก็บถาวร 2006-10-02 ที่ เวย์แบ็กแมชชีน
