Natriumhydroksid
| Natriumhydroksid | |||
|---|---|---|---|
 | |||
| Identifikatorer | |||
| CAS-nummer | |||
| Kjemiske egenskaper | |||
| Formel | NaOH | ||
| Molar masse | 39.9971 g mol−1 g/mol | ||
| Utseende | Hvit, voksaktige krystaller | ||
| Tetthet | 2130 kg/m3 | ||
| Smeltepunkt | 318 °C | ||
| Kokepunkt | 1388 °C | ||
| Løselighet | 418 g/L (0 °C) 1110 g/L (20 °C) 3370 g/L (100 °C) | ||
| Farer | |||
| Fare for huden | Etseskade | ||
| Fare for øyne | Etseskade | ||
Natriumhydroksid, natronlut eller kaustisk soda[1] er en sterk base, som består av ionene Na+ og OH-, med kjemisk formel NaOH. Natriumhydroksid er løselig i vann, etanol og metanol og lager en mettet løsning med omtrent 50 % natriumhydroksid i vekt. Det er en av de sterkeste basene vi kjenner til og har mange bruksområder, som i papirindustrien, i såper, vaskemidler og i avløpsrensing.
Anvendelse
[rediger | rediger kilde]Natriumhydroksid (NaOH) er en fast ioneforbindelse (et salt) som er bygd opp av Na+-ioner og OH--ioner. Når stoffet løses i vann, frigis ionene. Natriumhydroksid i fast form er allment kjent som kaustisk soda. Vannløsningen av natriumhydroksid kalles natronlut eller lut, og er en sterkt basisk væske. Natriumhydroksid brukes blant annet til å rense tilstoppede avløp (kjent under merkenavnet Plumbo), fremstille aluminium ved hjelp av bayerprosessen, fremstille såpe og til å lute treverk. Natriumhydroksid kan i likhet med kaliumhydroksid benyttes som katalysator under produksjon av biodiesel.[trenger referanse]
Farer
[rediger | rediger kilde]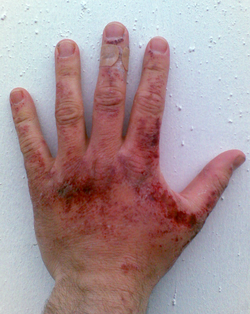
Natriumhydroksid og natronlut forårsaker etseskader som kan være varige. Dersom stoffet kommer i kontakt med øynene kan det medføre blindhet. Brukere av stoffet bør bruke hansker, vernebriller og beskyttende klær.
Når NaOH løses i vann skjer det en eksoterm reaksjon. Varmen kan forårsake brannskader i tillegg til etseskadene. Natronlut kan også danne en hvit og ugjennomsiktig hinne hvis det kommer i kontakt med øynene.
Produksjon
[rediger | rediger kilde]Natriumhydroksid ble tidligere fremstilt ved å behandle natriumkarbonat (soda-aske) med kalsiumhydroksid:
- Na2CO3 + Ca(OH)2 → 2NaOH + CaCO3
I moderne tid produseres natriumhydroksid ved klor-alkali metoden som går ut på elektrolyse av vannløst natriumklorid (bordsalt), men natriumhydroksid produsert ved denne metoden inneholder urenheter som f.eks, natriumoksiklorid, natriumkarbonat og natriumklorid. Natriumhydroksid kan også lages ved utluting av asken fra beinmel, ca. 30 % av beinmel-asken består av natriumoksid, som reagerer med vann under dannelse av natriumhydroksid. Resultatet er en konsentrert natronlut, denne kan brukes som den er eller anhydreres til kaustisk soda.[trenger referanse]
Reaksjoner
[rediger | rediger kilde]For å nøytralisere en sterk base som natriumhydroksid er det naturlig å bruke en sterk syre. Man kan nøytralisere natriumhydroksid med saltsyre (HCl), man får da en nøytral løsning bestående av vanlig bordsalt (NaCl) løst i vann. Reaksjonen er eksoterm, og det bør ikke helles store mengder konsentrert syre i konsentrert base og motsatt. En slik reaksjon kan også bli brukt i titrering for å finne konsentrasjonen av den sure eller basiske løsningen.
- NaOH(aq) + HCl(aq) → NaCl(aq) + H2O(l)
Natriumhydroksid løst i vann reagerer med aluminium og produserer hydrogengass. Reaksjonen er svært eksoterm og skaper store mengder varme og gass.
- 2 Al + 2 NaOH + 6 H2O = 2 NaAl(OH)4 + 3 H2
Se også
[rediger | rediger kilde]Referanser
[rediger | rediger kilde]- ^ Pedersen, Bjørn (23. august 2023). «natriumhydroksid». Store norske leksikon (på norsk). Besøkt 22. november 2023.
Kilder
[rediger | rediger kilde]- U.S. National Library of Medicine HSDB Databse: Sodium Hydroxide Besøkt 15. januar 2017
