Difluoruro di zolfo
| Difluoruro di zolfo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| difluoruro di zolfo, fluoruro di zolfo(II) | |
| Nomi alternativi | |
| difluorosolfano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | F2S |
| Peso formula (u) | 70,062 |
| Aspetto | gas incolore[1] |
| Numero CAS | |
| PubChem | 139605 |
| SMILES | FSF |
| Proprietà chimico-fisiche | |
| Temperatura di fusione | 650 °C (923 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | –298[1] |
| Indicazioni di sicurezza | |
| Frasi H | --[2] |
Il difluoruro di zolfo o fluoruro di zolfo(II) è il composto inorganico con formula SF2. In questo fluoruro lo zolfo è nello stato di ossidazione +2. È un gas incolore molto instabile.[1][3] Il composto fu caratterizzato per la prima volta nel 1969 osservandone lo spettro rotazionale.[4]
Sintesi
[modifica | modifica wikitesto]SF2 si può generare facendo reagire dicloruro di zolfo con fluoruro di potassio o con fluoruro di mercurio(II):[3]
Alternativamente si può fluorurare il solfuro di carbonile con fluoro:[1][5]
Proprietà
[modifica | modifica wikitesto]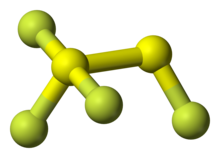
La molecola SF2 ha forma angolare, con simmetria C2v; l'angolo F–S–F è di 98° e la distanza F–S è 159 pm.[4] Il composto è molto instabile e dimerizza formando FSSF3. Si ritiene che questa specie asimmetrica si formi per inserzione di una molecola SF2 nel legame S–F di una seconda molecola SF2.[3]
Note
[modifica | modifica wikitesto]- ^ a b c d Holleman e Wiberg 2007
- ^ Questa sostanza non è stata ancora classificata in termini di pericolosità o non è stata ancora trovata una fonte affidabile e citabile.
- ^ a b c Greenwood e Earnshaw 1997
- ^ a b Johnson e Powell 1969
- ^ Deroche et al. 1981
Bibliografia
[modifica | modifica wikitesto]- (EN) J.-C. Deroche, H. Bürger, P. Schulz e H. Willner, Infrared spectrum of sulfur difluoride in the gas phase around 12.5 µm, in J. Mol. Spectrosc., vol. 89, n. 2, 1981, pp. 269-275, DOI:10.1016/0022-2852(81)90022-9.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) D. R. Johnson e F. X. Powell, Microwave Spectrum and Structure of Sulfur Difluoride, in Science, vol. 164, n. 3882, 1969, pp. 950-951, DOI:10.1126/science.164.3882.950.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su difluoruro di zolfo
Wikimedia Commons contiene immagini o altri file su difluoruro di zolfo



