Acido barbiturico
| Acido barbiturico | |
|---|---|
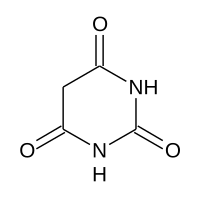 | |
 | |
| Nome IUPAC | |
| 1H,3H,5H-pirimidin-2,4,6-trione | |
| Nomi alternativi | |
| malonilurea 2,4,6-triidrossipirimidina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H4N2O3 |
| Massa molecolare (u) | 128,09 g/mol |
| Aspetto | solido biancastro |
| Numero CAS | |
| Numero EINECS | 200-658-0 |
| PubChem | 6211 |
| SMILES | C1C(=O)NC(=O)NC1=O |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida (pKa) a 298 K | 4,0 |
| Solubilità in acqua | 142 g/l (20 °C) |
| Temperatura di fusione | 250 °C (523 K) (decomposizione) |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
L'acido barbiturico o malonilurea è, chimicamente, l'ureide ciclica dell'acido malonico. Esso è il capostipite di un'importante classe di farmaci: i barbiturici. Il termine barbiturico deriva dal lichene Usnea barbata,[2] da cui si ricava l'acido malonico, e dall'urea. A temperatura ambiente si presenta come un solido biancastro dall'odore tenue.
In passato alcuni suoi derivati erano usati nella pratica clinica in modo massiccio: il Veronal (acido dietil barbiturico) come sedativo e il tiopental sodico (acido metil-pentil barbiturico) come farmaco ipnotico. Data la dipendenza e la tolleranza che questi farmaci causano ed in considerazione della pericolosità che presentano (i barbiturici possono determinare con relativa facilità un'intossicazione potenzialmente letale), a partire dagli anni settanta furono sostituiti dalle benzodiazepine. Seppur in disuso, oggi continuano ad essere prescritti come antiepilettici e per il trattamento di eventi traumatici della testa, inoltre sono utilizzati anche in anestesia. L'acido barbiturico è tossico ma, contrariamente ai suoi derivati, non è farmacologicamente attivo.
Proprietà chimiche
[modifica | modifica wikitesto]L'acidità del composto è data dai due atomi di idrogeno legati all'atomo di carbonio in posizione 5 sull'anello eterociclico che, trovandosi in posizione alfa rispetto a due carbonili, acquistano in ambiente acquoso un carattere acido per via della risonanza che stabilizza l'anione che viene a formarsi a seguito del loro distacco come ioni H+.
In virtù delle sue proprietà chimiche, all'anione barbiturato è facile legare carbocationi acilici o aromatici, reazione fondamentale per la sintesi di molti barbiturici per uso terapeutico.
Storia
[modifica | modifica wikitesto]Il 4 dicembre 1863 Adolf von Baeyer sintetizzò l'acido barbiturico a partire dall'urea e dall'acido malonico. Il nome si deve alla Santa festeggiata in quel giorno ed alla compagna di von Baeyer che pure si chiamava Barbara, più il suffisso che ricordava la derivazione dall'urea. Nel 1903 Emil Hermann Fischer e Joseph von Mering prepararono il barbital, il primo vero e proprio barbiturico, che fu commercializzato con il nome di Veronal. Nel 1912 fu introdotto nel mercato un nuovo barbiturico ad attività sedativo-ipnotico, il fenobarbital con il nome commerciale di Luminal. Tra il 1950 e il 1960 fu dimostrato che i barbiturici causano dipendenza. Il Fenobarbital, Secobarbital, Amobarbital, Butalbital sono i barbiturici più commercializzati. Alcuni, come il Fenobarbital, sono ampiamente usati come antiepilettici, altri sono caduti in disuso.
Note
[modifica | modifica wikitesto]- ^ scheda dell'acido barbiturico su IFA-GESTIS
- ^ Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner: Enzyklopädie Medizingeschichte, De Gruyter Verlag, 1. Auflage 2004, p. 138, ISBN 3-11-015714-4
Voci correlate
[modifica | modifica wikitesto]- Acido valproico
- Antiepilettici
- Assenza tipica
- Benzodiazepine
- Butalbital
- Carbamazepina
- Carbammati
- Clobazam
- Clonazepam
- Epilessia
- Epilessia tipo assenza infantile
- Etosuccimide
- Felbamato
- Fenitoina
- Fenobarbitale
- Gabapentin
- Idantoina
- Imminostilbeni
- Lamotrigina
- Metoesital sodico
- Ossazolidindioni
- Oxcarbazepina
- Primidone
- Proponal
- Rufinamide
- Stiripentolo
- Succinimmidi
- Tiagabina
- Topiramato
- Vigabatrin
- Mefobarbital
- Metabarbital
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «acido barbiturico»
Wikizionario contiene il lemma di dizionario «acido barbiturico» Wikimedia Commons contiene immagini o altri file su acido barbiturico
Wikimedia Commons contiene immagini o altri file su acido barbiturico
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) barbituric acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 24810 · GND (DE) 4144030-4 · BNF (FR) cb119377034 (data) |
|---|


