Solfato d'ammonio
| Solfato d'ammonio | |
|---|---|
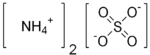 | |
 | |
| Nomi alternativi | |
| tetraossosolfato(VI) di diammonio | |
| Caratteristiche generali | |
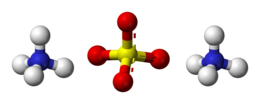
| Formula bruta o molecolare | (NH4)2SO4 |
| Massa molecolare (u) | 132,14 |
| Aspetto | solido bianco incolore |
| Numero CAS | |
| Numero EINECS | 231-984-1 |
| PubChem | 24538 e 6097028 |
| SMILES | [NH4+].[NH4+].[O-]S(=O)(=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,769 g/cm³ (20 °C) |
| Solubilità in acqua | 754 g/L (20 °C) |
| Temperatura di fusione | 280 °C (560 K) (decomposizione) |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 2840 mg/kg, topo (orale) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 315 - 319 - 335 |
| Consigli P | 261 - 264 - 270 - 271 - 273 - 280 - 301+312 - 302+352 - 304+340 - 305+351+338 - 312 - 321 - 330 - 332+313 |
Il solfato d'ammonio è un sale di ammonio dell'acido solforico, di formula (NH4)2SO4. Viene prodotto industrialmente per reazione diretta fra acido solforico e ammoniaca.
A temperatura ambiente si presenta come un solido biancastro-incolore inodore.[1] Esso viene utilizzato nell'industria chimica ed anche come fertilizzante in agricoltura.
Usi
[modifica | modifica wikitesto]L'uso principale del solfato di ammonio è come fertilizzante per terreni alcalini. Nel terreno lo ione ammonio viene rilasciato e forma una piccola quantità di acido, abbassando il pH del terreno, e apportando l'azoto essenziale per la crescita delle piante. Lo svantaggio principale per l'uso del solfato di ammonio è il basso contenuto di azoto rispetto al nitrato d'ammonio.[2]
Viene anche usato come coadiuvante per insetticidi solubili in acqua, erbicidi, e fungicidi. In queste formulazioni funziona per legare i cationi ferro e calcio che sono presenti sia in acqua e nelle cellule vegetali.
Uso di laboratorio
[modifica | modifica wikitesto]In biochimica, il solfato di ammonio è utilizzato per purificare le proteine tramite precipitazione selettiva; questo sale è estremamente solubile in acqua e quindi può rendere le soluzioni molto concentrate, in grado di effettuare un "salting out" delle proteine, provocando la loro precipitazione.[3]
Nell'analisi della gomma, alcuni acidi grassi volatili vengono analizzati mediante precipitazione della gomma con una soluzione di solfato di ammonio al 35%, che lascia un liquido trasparente da cui gli acidi grassi volatili sono rigenerati con acido solforico e quindi distillati a vapore. La precipitazione selettiva con solfato di ammonio quindi, di fronte alla consueta tecnica di precipitazione che utilizza acido acetico, non interferisce con la determinazione degli acidi grassi volatili.[4]
Uso come additivo alimentare
[modifica | modifica wikitesto]Il solfato di ammonio si considera generalmente riconosciuto come additivo alimentare sicuro (GRAS, "generally recognized as safe") dall'agenzia statunitense Food and Drug Administration (FDA), e l'Unione europea lo ha indicato con il numero E: E517. È usato come un regolatore di acidità in farine e pane.[5][6]
Altri usi
[modifica | modifica wikitesto]Viene utilizzato su piccola scala per la preparazione di altri sali di ammonio, specialmente ammonio persolfato.
Una soluzione satura di solfato di ammonio in acqua pesante (D2O) è usato come uno standard esterno nella spettroscopia NMR dello zolfo (33S) ponendo il suo chemical shift a 0 ppm.
Il solfato di ammonio è stato utilizzato anche in composizioni ritardanti di fiamma poiché agisce molto similmente al fosfato di diammonio. Come un ritardante di fiamma, aumenta la temperatura di combustione del materiale, diminuisce la velocità di perdita di peso, e provoca un aumento della produzione di residui o char.[7]
Viene anche usato come conservante del legno, ma a causa della sua natura igroscopica, questo uso è stato ampiamente interrotto a causa di problemi associati con la corrosione dei metalli e altre problematiche associate.
Preparazione
[modifica | modifica wikitesto]Il solfato di ammonio è realizzato trattando ammoniaca con acido solforico:
Una miscela di gas di ammoniaca e vapore acqueo viene introdotta in un reattore contenente una soluzione satura di solfato di ammonio e circa da 2 a 4% di acido solforico a 60 °C. L'acido solforico concentrato viene aggiunto per mantenere la soluzione acida, e di mantenere il suo livello di acido libero. Il calore di reazione mantiene la temperatura del reattore costante a 60 °C. Il solfato di ammonio secco in polvere può essere formato spruzzando acido solforico in una camera di reazione caricata con ammoniaca gassosa. Il calore di reazione evapora tutta l'acqua presente nel sistema, formando un sale polveroso.[2]
Il solfato di ammonio è anche prodotto dal gesso (CaSO4 · 2H2O). Il gesso finemente suddiviso viene aggiunto ad una soluzione di carbonato di ammonio, quindi Il carbonato di calcio precipita lasciando il solfato di ammonio nella soluzione.
Il solfato d'ammonio è anche presente nel minerale mascagnite nelle fumarole vulcaniche.[8]
Altre proprietà
[modifica | modifica wikitesto]Il solfato di ammonio diventa ferroelettrico a temperature inferiori a -49,5 °C. A temperatura ambiente cristallizza nel sistema ortorombico, con dimensioni delle celle di a = 7,729 Å, b=10.560 Å, C=5,951 Å. Quando raffreddati nello stato ferrorelettrico, la simmetria del cristallo cambia al gruppo spaziale Pna21.[9]
Reattività
[modifica | modifica wikitesto]Il solfato di ammonio si decompone al di sopra dei 250 °C, portando alla formazione di bisolfato di ammonio. Riscaldamento a temperature più elevate si provoca la decomposizione in ammoniaca, azoto, biossido di zolfo, e acqua.[10]
Per riscaldamento in ambiente basico libera ammoniaca, che può essere evidenziata con il reattivo di Nessler che produce una colorazione rosso/arancione (con precipitato se la concentrazione dell'ammoniaca è elevata). Saggio qualitativo: introdurre in una provetta una goccia di soluzione acquosa di solfato di ammonio e tre gocce di soluzione di soda caustica (idrossido di sodio 2:5 4M). Avvicinare alla soluzione il fondo di una provetta bagnato con il reattivo di Nessler, scaldare a bagnomaria e verificare lo sviluppo del colore rosso arancione. Limite di sensibilità 1 ppm
In acqua si scioglie fino a circa 5.7 moli/L (infatti pesa 132 g/mol ed ha una solubilità di 754g/L) e dissocia una mole di ione solfato e due moli di ioni ammonio ogni mole di sale sciolto.
Essendo il solfato di ammonio un sale di un acido forte (H2SO4) e base debole (NH3), le sue soluzioni sono acide; Il pH di una soluzione 0,1 M è 5,5.
In soluzione acquosa le reazioni sono quelli degli ioni NH4+ e SO4-2. Ad esempio, all'aggiunta di cloruro di bario precipita il solfato di bario insolubile. Il filtrato per evaporazione produce cloruro di ammonio.
L'ammonio NH4+ viene ossidato in ambiente acido dall'acqua regia, dal cloro, dal bromo e in ambiente basico dall'ipoclorito e dal permanganato. Nell'ambiente, esempio suolo in presenza di umidità e/o in acqua, essendo in equilibrio chimico con l'ammoniaca, può essere ossidato biologicamente dai batteri aerobici producendo nitriti e nitrati. Pertanto il solfato di ammonio disperso nell'ambiente non è inerte ma è responsabile, come tante altre sostanze fertilizzanti, dell'eutrofizzazione delle acque. L'ammonio è in equilibrio con l'ammoniaca nel terreno e la loro reciproca concentrazione dipende dal pH e dalla temperatura[11]
Esso forma molti sali doppi (solfati di ammonio metallico) quando la sua soluzione viene miscelata con soluzioni equimolari di solfati metallici e si evapora lentamente il tutto. Con ioni metallici trivalenti, sono formate allumi come il solfato di ammonio ferrico.solfati metallici doppi includono il cobalto ammonio solfato, il solfato ferroso di ammonio, il nichel ammonio solfato che sono conosciuti come i sali di Tutton e infine il cerio ammonio solfato.[2] Solfati doppi anidri d'ammonio si ritrovano anche nella famiglia delle Langbeiniti.
Note
[modifica | modifica wikitesto]- ^ Ammonium sulfate | Sigma-Aldrich, su sigmaaldrich.com. URL consultato il 20 settembre 2016.
- ^ a b c (EN) Karl-Heinz Zapp, Karl-Heinz Wostbrock e Manfred Schäfer, Ammonium Compounds, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 1º gennaio 2000, DOI:10.1002/14356007.a02_243, ISBN 9783527306732. URL consultato il 20 settembre 2016.
- ^ Ammonium Sulfate Calculator from EnCor Biotechnology Inc., su encorbio.com. URL consultato il 20 settembre 2016.
- ^ ASTM Standard Specification for Rubber Concentrates D 1076-06
- ^ Panera Bread › Menu & Nutrition › Nutrition Information Profile, su panerabread.com, 19 agosto 2009. URL consultato il 20 settembre 2016 (archiviato dall'url originale il 19 agosto 2009).
- ^ Sarah Klein Senior Editor, The Grossest Ingredients Hidden In Processed Foods, su The Huffington Post, 14 maggio 2012. URL consultato il 20 settembre 2016.
- ^ Ronald A. Susott, Utah) Intermountain Forest and Range Experiment Station (Ogden e C. W. George, Effects of ammonium phosphate and sulfate on the pyrolysis and combustion of cellulose, Intermountain Forest & Range Experiment Station, Forest Service, U.S. Dept. of Agriculture, 1º gennaio 1971. URL consultato il 20 settembre 2016.
- ^ Mascagnite: Mascagnite mineral information and data., su mindat.org. URL consultato il 20 settembre 2016.
- ^ (EN) Y. Okaya, K. Vedam e R. Pepinsky, Non-isomorphism of ferroelectric phases of ammonium sulfate and ammonium fluoberyllate, in Acta Crystallographica, vol. 11, n. 4, 10 aprile 1958, pp. 307–307, DOI:10.1107/s0365110x58000803. URL consultato il 20 settembre 2016.
- ^ 硫酸铵的热分解 Studies on the thermal decomposition of ammonium sulfate, su d.wanfangdata.com.cn. URL consultato il 20 settembre 2016.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Solfato d'ammonio
Wikimedia Commons contiene immagini o altri file su Solfato d'ammonio
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) ammonium sulfate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4299792-6 · NDL (EN, JA) 00569904 |
|---|

