Naftalene
| Naftalene | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| naftalene | |
| Nomi alternativi | |
| naftalina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C10H8 |
| Peso formula (u) | 128,16 |
| Aspetto | solido cristallino incolore |
| Numero CAS | |
| Numero EINECS | 202-049-5 |
| PubChem | 931 |
| SMILES | C1=CC=C2C=CC=CC2=C1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,15 |
| Solubilità in acqua | 0,03 g/L a 20 °C (293 K) |
| Temperatura di fusione | 80 °C (353 K) |
| Temperatura di ebollizione | 218 °C (491 K) |
| Tensione di vapore (Pa) a 25 °C (298 K) K | 10,5 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 78,5 |
| ΔfG0 (kJ·mol−1) | 201,6 |
| S0m(J·K−1mol−1) | 167,4 |
| C0p,m(J·K−1mol−1) | 165,7 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 228 - 351 - 300 - 302 - 410 |
| Consigli P | 210 - 280 - 301+312+330 - 370+378 [1] |
Il naftalene, commercialmente noto anche come naftalina, è un idrocarburo aromatico biciclico, solido cristallino incolore, dotato di caratteristico odore intenso, avente formula molecolare C10H8.[2]
Secondo una classificazione è il più semplice tra gli idrocarburi policiclici aromatici[3] ma, secondo un'altra, questi ultimi iniziano da quelli triciclici, cioè da antracene e fenantrene.[4][5]
È contenuto naturalmente nel catrame di carbon fossile ed è l'ingrediente caratteristico delle tradizionali palline antitarme utilizzate negli armadi per proteggere i capi di lana.
Etimologia
[modifica | modifica wikitesto]
Il termine «naftalina» viene dal francese naftaline, da nafta e questo dal latino tardo naphtha,[6] a sua volta derivato dal greco νάφθα (nàftha),[7] ricalcato su una radice araba, ebraica, persiana o caldaica «naft-».[8][9] Questi termini sono riferibili a petrolio, nafta o bitume.[6][7] Il naftalene è infatti contenuto nel catrame di carbon fossile, dal quale può essere estratto.[10] Al tema «naftal-» del nome francese è stato poi aggiunto «-ene»,[11] che è il suffisso generale usato per designare l'insaturazione in alcheni e areni.[12]
Storia
[modifica | modifica wikitesto]Agli inizi del 1820 due studi riportarono la descrizione di un solido bianco, caratterizzato da odore pungente e derivato dal catrame di carbone. Nel 1821 John Kidd citò questi due studi e descrisse le proprietà e il metodo di produzione di questa sostanza, proponendo di chiamarla naftalina, in quanto era un derivato di quello che allora rientrava sotto il nome generico di nafta.[13]
La formula chimica del naftalene fu poi determinata da Michael Faraday nel 1826, mentre la sua struttura risultante dalla fusione di due anelli benzenici fu proposta da Emil Erlenmeyer nel 1866,[14] e confermata tre anni più tardi da Carl Gräbe.[15]
Caratteristiche
[modifica | modifica wikitesto]A temperatura ambiente è un solido cristallino incolore e volatile: sublima facilmente, originando così un odore intenso e caratteristico, rilevabile già a concentrazioni di 0,08 ppm.[16] È infiammabile e brucia con fiamma gialla, luminosa e fuligginosa.[17] Poco solubile in acqua, si scioglie abbastanza bene in etanolo (11,3 g/100 g a 25 °C)[18] e ancora meglio nei solventi meno polari, come etere o cloroformio o apolari, come benzene, toluene o solfuro di carbonio.[19]
Struttura molecolare
[modifica | modifica wikitesto]Il naftalene è un idrocarburo benzenoide,[20] la sua molecola è planare e comprende due anelli benzenici condensati, che condividono cioè due atomi di carbonio adiacenti (atomi 'teste di ponte'), anelli che contengono complessivamente 5 doppi legami e quindi 10 elettroni π. In tal modo, il naftalene si conforma al criterio di aromaticità di Hückel dei 4n+2 elettroni π, con n = 2. Il criterio è strettamente valido solo per sistemi monociclici,[21] ma l'aromaticità del naftalene è comunque assodata da evidenze sperimentali.[22]
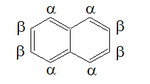
La sua molecola è un ibrido di risonanza di 3 forme limite (strutture di Kekulé), 2 delle quali tra loro equivalenti e una terza con un doppio legame tra i carboni a testa di ponte, quindi equamente condiviso tra i due anelli, ma non presente nelle altre due; In maniera simile, anche la molteplicità dei legami nelle posizioni 1-2 e 2-3, ed altri, sono diversamente rappresentate.[23] Questo può già render conto qualitativamente del fatto che, diversamente dal benzene, le lunghezze di legame C−C nel naftalene sono un po' differenti tra loro, come si è dimostrato sperimentalmente da indagini di diffrazione dei raggi X su un monocristallo di naftalene e da indagini di diffrazione elettronica in fase gassosa, dalle quali risulta che la simmetria della molecola appartiene al gruppo puntuale D2h, per cui il naftalene ha solo due possibili derivati monosostituiti diversi, quelli in posizione 1- (o α-) e quelli in posizione 2- (o β-).[24]
Di quest'ultima indagine, sono qui di seguito riportati alcuni dati salienti come lunghezze (r) ed angoli di legame (∠):[24]
r(C–H) = 109,2 pm;
r(C1–C2) = 138,1 pm; r(C2–C3) = 141,7 pm; r(C8a–C1) = 142,2 pm; r(C8a–C4a) = 141,2 pm;
∠(C4aC8aC1) = 119,5°; ∠(C1C8aC8) = 121,0° (dedotto).
Come si vede, il legame C1−C2 è significativamente più corto di quello del benzene (139,7 pm[25]) e più corto di tutti gli altri: il legame C2−C3 e gli altri due simili, compresi tra 141 e 142 pm. I legami C–H hanno lunghezze praticamente normali (109 pm[26]). L'angolo interno C4aC8aC1, inferiore ai 120° teorici per l'ibridazione sp2 degli atomi di carbonio e per la chiusura degli anelli esaatomici planari ed è compensato da quello esterno è appena superiore.
Reattività
[modifica | modifica wikitesto]Dal punto di vista chimico la sua aromaticità è minore di quella del benzene: una conseguenza di ciò è che i suoi legami sono di lunghezze diverse[27]. Il naftalene; dal punto di vista chimico reagisce con sostanze ossidanti quali il permanganato di potassio per dare l'acido ftalico, oppure in condizioni di ossidazione più blande, per esempio con anidride cromica, un naftochinone. Può essere inoltre ridotto con sodio metallico in ammoniaca liquida e etanolo (condizioni della riduzione di Birch) a dare l'1,4 diidronaftalene. Inoltre come il benzene, subisce facilmente reazioni di sostituzione elettrofila aromatica, orientate prevalentemente in posizione α (posizione 1), in misura minore la sostituzione può avvenire in β (posizione 2), che è meno reattiva, ma anche meno ingombrata a livello sterico.
Per idrogenazione catalitica viene convertito in decalina (decaidronaftalene), oppure in condizione catalitiche differenti in tetralina (1,2,3,4-tetraidronaftalene).
Per ottenere il prodotto completamente ridotto è noto l'uso di Rh/C o Pt/C come catalizzatore, mentre per il secondo catalizzatori quali Ni o Pd/C in ogni caso a temperatura e pressione elevata.
Produzione naturale e industriale e usi
[modifica | modifica wikitesto]Industrialmente si ottiene per distillazione dal catrame, dal carbone e dal petrolio.
In natura tracce di naftalene sono prodotte dalle magnolia e da alcune specie di cervi,[28] oltre che dalle termiti di Formosa (Coptotermes formosanus) probabilmente come repellente contro le formiche, i funghi velenosi e i vermi nematodi.[29]
Oltre all'impiego nell'industria chimica principalmente come materia prima per la sintesi dell'anidride ftalica e di coloranti (Acido H), trova uso domestico anche come insetticida, specialmente contro le tarme. In passato è stato utilizzato come combustibile nel campo automobilistico e ferroviario, ma necessitava di un altro carburante per avviare il motore e portarlo alla temperatura di esercizio di 80 °C per sciogliere la naftalina.
Anche alcune varietà del fungo endofita Muscodor albus producono naftalene assieme ad altri composti organici volatili, mentre il Muscodor vitigenus produce pressoché esclusivamente naftalene.[30]
Tracce di naftalene sono state trovate anche in alcune meteoriti rilevate dalla seguente reazione:
n C10H7-SO3H + n CH2O → SO3H-C10H7-(-CH2-C10H7-SO3H)n + n H2O.
Precauzioni
[modifica | modifica wikitesto]L'esposizione eccessiva al naftalene provoca la distruzione dei globuli rossi e produce sintomi di nausea, vomito, diarrea, passaggio di sangue nelle urine e pallore della pelle. È inoltre classificata nel gruppo 2B tra i possibili cancerogeni, secondo l'Agenzia internazionale per la ricerca sul cancro (IARC).[31]
Note
[modifica | modifica wikitesto]- ^ scheda del naftalene su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ D. R. Bloch, Organic chemistry demystified, collana Demystified series, McGraw-Hill, 2006, pp. 374-375, ISBN 978-0-07-145920-4, OCLC ocm62093051. URL consultato il 30 marzo 2024.
- ^ Polycyclic Aromatic Hydrocarbons (PAHs) (PDF), su epa.gov.
- ^ (EN) Polycyclic Aromatic Hydrocarbons (PAHs): What Are Polycyclic Aromatic Hydrocarbons (PAHs)? | Environmental Medicine | ATSDR, su atsdr.cdc.gov, 26 maggio 2023. URL consultato il 7 settembre 2024.
- ^ (EN) Hyunok Choi, Roy Harrison e Hannu Komulainen, Polycyclic aromatic hydrocarbons, World Health Organization, 2010. URL consultato il 7 settembre 2024.
- ^ a b Naftalina - Significato ed etimologia - Ricerca, su Treccani. URL consultato il 26 settembre 2024.
- ^ a b Lorenzo Rocci, Vocabolario Greco Italiano, 37ª ed., Società editrice Dante Alighieri, 1993, p. 1269.
- ^ Etimologia : nafta;, su etimo.it. URL consultato il 26 settembre 2024.
- ^ Giovanni Semerano, Dizionario della Lingua Greca, collana Le Origini della Cultura Europea. Dizionari Etimologici, II Volume, Firenze, Leo S. Olschki Editore, 1944, p. 192, ISBN 88-222-4233-5.
- ^ (EN) N. A. Romanova, V. S. Leont’ev e A. S. Khrekin, Production of Commercial Naphthalene by Coal-Tar Processing, in Coke and Chemistry, vol. 61, n. 11, 2018-11, pp. 453–456, DOI:10.3103/S1068364X18110078. URL consultato il 26 settembre 2024.
- ^ Naftalène - Significato ed etimologia - Vocabolario, su Treccani. URL consultato il 15 ottobre 2024.
- ^ -ene > significato - Dizionario italiano De Mauro, su Internazionale. URL consultato il 14 ottobre 2024.
- ^ John Kidd, Observations on Naphthalene, a peculiar substance resembling a concrete essential oil, which is produced during the decomposition of coal tar, by exposure to a red heat, in Philosophical Transactions, vol. 111, 1821, pp. 209–221, DOI:10.1098/rstl.1821.0017.
- ^ Emil Erlenmeyer, Studien über die s. g. aromatischen Säuren, in Annalen der Chemie und Pharmacie, vol. 137, n. 3, 1866, pp. 327–359, DOI:10.1002/jlac.18661370309.
- ^ C. Graebe (1869) "Ueber die Constitution des Naphthalins". (Sulla struttura del naftalene), Annalen der Chemie und Pharmacie, 149 : 20-28.
- ^ Amoore J E and Hautala E, Odor as an aid to chemical safety: Odor thresholds compared with threshold limit values and volatiles for 214 industrial chemicals in air and water dilution, in J Appl Toxicology, vol. 3, n. 6, 1983, pp. 272–290, DOI:10.1002/jat.2550030603.
- ^ Fiamma - Enciclopedia, su Treccani. URL consultato il 16 ottobre 2024.
- ^ Atherton University of Michigan, Solubilities of inorganic and organic compounds; a compilation of quantitative solubility data from the periodical literature, New York, Van Nostrand, 1919, pp. 443-446. URL consultato il 26 settembre 2024.
- ^ naphthalene, su chemister.ru. URL consultato il 26 settembre 2024.
- ^ (EN) Ivan Gutman e Sven Josef Cyvin, Benzenoid Hydrocarbons, Springer Berlin Heidelberg, 1989, pp. 1–10, DOI:10.1007/978-3-642-87143-6_1, ISBN 978-3-642-87145-0. URL consultato il 26 settembre 2024.
- ^ (EN) John D. Roberts, Andrew Streitwieser e Clare M. Regan, Small-Ring Compounds. X. Molecular Orbital Calculations of Properties of Some Small-Ring Hydrocarbons and Free Radicals 1, in Journal of the American Chemical Society, vol. 74, n. 18, 1952-09, pp. 4579–4582, DOI:10.1021/ja01138a038. URL consultato il 26 settembre 2024.
- ^ Francis A. Carey e Richard J. Sundberg, 8.1.2. Structural Criteria for Aromaticity, in Advanced organic chemistry, 5th ed, Springer, 2007, ISBN 978-0-387-44897-8.
- ^ R.O.C. Norman, CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, pp. 56-57.
- ^ a b S. N. Ketkar e M. Fink, The molecular structure of naphthalene by electron diffraction, in Journal of Molecular Structure, vol. 77, n. 1, 1º novembre 1981, pp. 139–147, DOI:10.1016/0022-2860(81)85276-3. URL consultato il 26 settembre 2024.
- ^ Experimental data for C6H6 (Benzene), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ organic chemistry, oxford, p. 163.
- ^ (EN) J. W. Gassett, D. P. Wiesler e A. G. Baker, Volatile Compounds from the Forehead Region of Male White-Tailed Deer (Odocoileus virginianus), in Journal of Chemical Ecology, vol. 23, n. 3, 1º marzo 1997, pp. 569–578, DOI:10.1023/B:JOEC.0000006397.63647.5b. URL consultato il 26 settembre 2024.
- ^ Termite 'mothball' keep insects at bay, in Sci/Tech, BBC News, 8 aprile 1998.
- ^ Daisy BH, Strobel GA, Castillo U, etal, Naphthalene, an insect repellent, is produced by Muscodor vitigenus, a novel endophytic fungus, in Microbiology (Reading, Engl.), vol. 148, Pt 11, novembre 2002, pp. 3737–41, DOI:10.1099/00221287-148-11-3737, PMID 12427963.
- ^ monographs.iarc.who.int, https://monographs.iarc.who.int/agents-classified-by-the-iarc/.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «naftalene»
Wikizionario contiene il lemma di dizionario «naftalene» Wikimedia Commons contiene immagini o altri file su naftalene
Wikimedia Commons contiene immagini o altri file su naftalene
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) naphthalene, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Nitrazione del naftalene in laboratorio e meccanismo di reazione [collegamento interrotto], su itiskennedy.it.
| Controllo di autorità | Thesaurus BNCF 29641 · LCCN (EN) sh85089710 · GND (DE) 4171151-8 · BNF (FR) cb122930669 (data) · J9U (EN, HE) 987007558118205171 · NDL (EN, JA) 00575297 |
|---|