Un article de Wikipédia, l'encyclopédie libre.
Méthylmalonyl-CoA décarboxylase
modifier
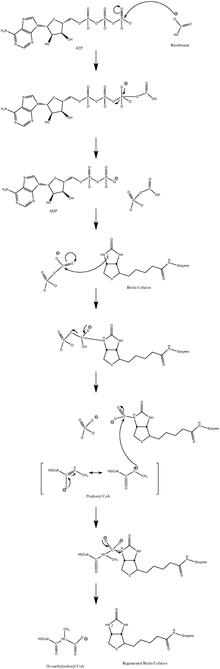
La propionyl-CoA carboxylase (PCC ) est une ligase , également classée comme lyase , qui catalyse la réaction :
ATP + propionyl-CoA + HCO3 −
⇌
{\displaystyle \rightleftharpoons }
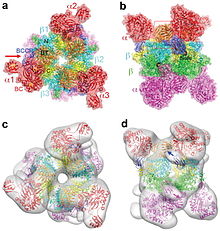
ADP + Pi + (S)-méthylmalonyl-CoA .Cette enzyme , qui utilise la biotine comme cofacteur , est présente dans les mitochondries des animaux , des plantes , des mycètes et des bactéries . Elle joue un rôle important dans le métabolisme des acides aminés et des lipides . Elle est constituée, chez l'homme , de six grosses sous-unités α et six sous-unités β plus petites, les premières se liant au groupe prosthétique biotine et à l'ATP tandis que les secondes contiennent le site actif .
La propionyl-CoA carboxylase intervient dans la dégradation d'acides aminés tels que l'isoleucine , la valine , la méthionine et la thréonine , ainsi que dans la dégradation des acides gras à nombre impair d'atomes de carbone et des acides gras ramifiés. Elle est également utilisée par certaines bactéries pour recycler l'acide propanoïque via la (S)-méthylmalonyl-CoA isomérisée en énantiomère (R) par une racémase puis convertie en succinyl-CoA méthylmalonyl-CoA mutase cycle de Krebs (réaction anaplérotique ).
Mécanisme réactionnel proposé pour la propionyl-CoA carboxylase.
↑
(en) Christine S. Huang, Kianoush Sadre-Bazzaz, Yang Shen, Binbin Deng, Z. Hong Zhou et Liang Tong , « Crystal structure of the α6 β6 », Nature vol. 466, 19 août 2010 , p. 1001–1005 (lire en ligne ) DOI 10.1038/nature09302 PMID 20725044