Almitrine
| Almitrine | |
| |
| Almitrine | |
| Identification | |
|---|---|
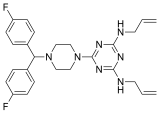
| Nom UICPA | 6-[4-[bis(4-fluorophényl)méthyl]pipérazin-1-yl]-N,N'- diprop-2-ényl-1,3,5-triazine-2,4-diamine |
| Synonymes |
Almitrin, Almitrine bismesylate, Almitrina, Almitrinum, Almitrine dimesylate, Almitrine [INN:BAN], Almitrinum [INN-Latin], Almitrina [INN-Spanish] |
| No CAS | |
| No ECHA | 100.044.054 |
| Code ATC | R07 |
| DrugBank | DB01430 |
| PubChem | 33887 |
| ChEBI | 53778 |
| SMILES | |
| InChI | |
| Propriétés chimiques | |
| Formule | C26H29F2N7 [Isomères] |
| Masse molaire[1] | 477,552 2 ± 0,024 2 g/mol C 65,39 %, H 6,12 %, F 7,96 %, N 20,53 %, |
| Données pharmacocinétiques | |
| Biodisponibilité | 3 heures |
| Liaison protéique | > 99 % |
| Métabolisme | hépatique |
| Demi-vie d’élim. | 116 à 140 heures[2] |
| Considérations thérapeutiques | |
| Voie d’administration | oral, IV |
| Grossesse | Contre-indiqué |
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'almitrine, commercialisée soit sous forme de bismésilate (en anglais : bismesylate), soit associée à la raubasine est un dérivé de diphénylméthylpipérazine classé « stimulant respiratoire » (R07AB07) dans la classification ATC (classification anatomique, thérapeutique et chimique). Elle améliore les paramètres gazométriques par stimulation agoniste des chémorécepteurs périphériques situés au niveau de l'aorte et des carotides[3].
Indications
[modifier | modifier le code]- L'almitrine seule est autorisée en France depuis 1982 dans l’indication d'insuffisance respiratoire avec hypoxémie en rapport avec une bronchopneumopathie chronique obstructive (BPCO)[4],[5].
- Associée à la raubasine, elle a perdu son autorisation de mise sur le marché le [6].
Effets indésirables
[modifier | modifier le code]- Nausées
- Pyrosis
- Amaigrissement
- Neuropathies périphériques avec paresthésies.
En , l'Agence nationale de sécurité du médicament et des produits de santé (ANSM), en France, considère que « l'efficacité des médicaments contenant de l'almitrine s’avère insuffisante alors que persistent des préoccupations en matière de sécurité d’emploi (principalement neuropathies périphériques et perte de poids). »[7]
En attendant la décision du « Groupe de coordination pour la reconnaissance mutuelle et les procédures décentralisées - médicaments à usage humain » (CMDh), l'ANSM recommande aux prescripteurs de ne plus initier de traitement par almitrine[7],[Note 1].
Le , à la demande de l'ANSM, les médicaments à base d'almitrine ont été réévalués en raison de préoccupations concernant les effets secondaires et en raison d'un risque de neuropathies périphériques et de perte de poids, l'almitrine est retirée du marché européen de façon définitive le [8].
Notes et références
[modifier | modifier le code]Notes
[modifier | modifier le code]- L'almitrine en injection intraveineuse n'est pas incluse dans cette recommandation dans le cadre de « la prise en charge des syndromes respiratoires aigus comme traitement adjuvant à la ventilation mécanique, notamment dans le cadre du sevrage de celle-ci dans les cas les plus graves et en l’absence de dispositif de suppléance respiratoire adapté. »
Références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Bury T, Jeannot JP, Ansquer JC, Radermecker M, « Dose-response and pharmacokinetic study with almitrine bismesylate after single oral administrations in COPD patients », The European respiratory journal, vol. 2, no 1, , p. 49-55 (PMID 2495983, résumé)
- (en) G.E. Bisgard, « The response of few-fiber carotid chemoreceptor preparations to almitrine in the dog », Canadian journal of physiology and pharmacology, vol. 59, no 4, , p. 396-401 (PMID 6113042, résumé)
- Commission de transparence, Haute Autorité de santé, France,
- (en) François Bagate, Samuel Tuffet, Paul Masi et François Perier, « Rescue therapy with inhaled nitric oxide and almitrine in COVID-19 patients with severe acute respiratory distress syndrome », Annals of Intensive Care, vol. 10, no 1, , p. 151 (ISSN 2110-5820, PMID 33150525, PMCID PMC7641257, DOI 10.1186/s13613-020-00769-2, lire en ligne, consulté le )
- « Retrait de l'autorisation de mise sur le marché de la spécialité Duxil® - ANSM : Agence nationale de sécurité du médicament et des produits de santé », ANSM, (consulté le )
- « Médicaments à base de tétrazépam, d’almitrine, de ranélate de strontium et de codéine (chez l’enfant) : avis et recommandations du PRAC - Communiqué de l’EMA - ANSM : Agence nationale de sécurité du médicament et des produits de santé », ANSM, (consulté le )
- European Medicines Agency, « Oral almitrine to be withdrawn by EU Member States », (consulté le )
