برشنگاری با گسیل پوزیترون
| برشنگاری با گسیل پوزیترون | |
|---|---|
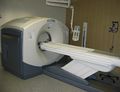
 تصویری از یک دستگاه پت اسکن | |
| ICD-10-PCS | C?۳ |
| ICD-9-CM | 92.0-92.1 |
| سرعنوانهای موضوعی پزشکی | D049268 |
| OPS-301 code | ۳–۷۴ |
| مدلاین پلاس | ۰۰۳۸۲۷ |
برشنگاری با گسیل پوزیترون یا توموگرافی گسیل پوزیترون (به انگلیسی: Positron Emission Tomography) که به اختصار پِت اسکن (انگلیسی: PET scan) گفته میشود، یک تکنیک تصویربرداری عملکردی است که از مواد رادیواکتیو که به عنوان رادیو ردیاب شناخته میشوند برای تجسم و اندازهگیری تغییرات در فرآیندهای متابولیک و سایر فعالیتهای فیزیولوژیکی از جمله جریان خون، ترکیبات شیمیایی و جذب آنها مورد استفاده قرار میگیرد.[۱] ردیابهای مختلف برای اهداف تصویربرداری مختلف بسته به فرایند هدف در بدن استفاده میشوند برای مثال از فلوئورودوکسی گلوکز ([18F] FDG یا FDG) معمولاً برای تشخیص سرطان،[۲][۳] سدیم فلوئورید (Na18F) بهطور گسترده برای تشخیص تشکیل استخوان و در برخی موارد اکسیژن 15 (15O) برای اندازهگیری جریان خون استفاده میشود.[۴][۵]
PET یک تکنیک سینتیلوگرافی پزشکی است که در پزشکی هستهای استفاده میشود. یک رادیودارو (یک رادیو ایزوتوپ متصل به یک دارو) به عنوان ردیاب به بدن تزریق میشود. هنگامی که رادیودارو تحت واپاشی بتا پلاس قرار میگیرد، یک پوزیترون ساطع میشود، و هنگامی که پوزیترون با یک الکترون معمولی برهمکنش میکند، دو ذره از بین میروند و دو پرتو گاما در جهت مخالف ساطع میکنند.[۵] این پرتوهای گاما توسط دو دوربین گاما شناسایی میشوند تا یک تصویر سه بعدی را تشکیل دهند (اشعه گاما را که بهطور غیرمستقیم توسط یک رادیونوکلئوتایس پوزیترون منتشر میشود تشخیص میدهد).[۶]
اسکنرهای PET را میتوانند همزمان با یک اسکنر سیتی اسکن (CT) استفاده کرد و به عنوان اسکنر PET-CT شناخته میشوند. همچنین تصاویر PET را میتوان با استفاده از سیتی اسکن انجام شده از یک اسکنر در همان جلسه بازسازی کرد. یکی از معایب اسکنر PET هزینه اولیه بالا و هزینههای عملیاتی مداوم آن است.[۷]
روش کار
[ویرایش]دستگاه متداولی که این روش را جهت تصویر برداری به کار میبرد پت اسکن نام دارد و متشکل از چند هزار آشکارساز کوچک (از نوع BG و LO) است که بهصورت انطباقی پرتوهای گاما ۵۱۱keV تولید شده از نابودی جفتهای الکترون و پوزیترون از درون بدن بیمار آشکارسازی میکند.
در تصویربرداری با روشهای هستهای همانند PET، هر چند رزولوشن در مقایسه با CT بسیار پایینتر است، اما با این وجود فواید و امکانات بینظیری در اختیارمان قرار میدهد:
- ارائه تصویر از عملکرد بخشهای مختلف بدن و امکان دستیابی به اطلاعات متابولیکی و شیمیایی بدن
- امکان تشخیص نواحی سرطانی و بدخیم در بافتهای سلولی
- امکان تشخیص و ردیابی ناهنجاریها در فعالیتهای سلولی پیش از آنکه تغییراتی در آناتومی اعضا به صورت محسوس، ایجاد کنند.
قیمت هر دستگاه تا دو میلیون دلار تخمین زده میشود[۸] و اخیراً این دستگاهها با سی تی اسکن به صورت ترکیبی (PET/CT) وارد بازار شدهاند.
از آنجایی که برای آشکارسازی تلاشی جفتی احتیاج به رادیو ایزوتوپهای با نیمه عمر کمتر از دو ساعت میباشد، پت اسکن را اغلب در مجاورت یک دستگاه شتابدهنده نصب میکنند. پر مصرفترین این ایزوتوپها فلور-۱۸ است که نیمه عمر آن حدود ۱۱۰ دقیقهاست. خرید و نصب اینگونه شتابدهندهها خود حدود یک میلیون دلار هزینه دربردارد.[۸]
کاربرد
[ویرایش]تومورشناسی
[ویرایش]
اسکن PET با فلوئور ردیاب 18 (F-18) فلوریدوکسو گلوکوز (FDG)، به نام FDG-PET، بهطور گسترده در انکولوژی بالینی استفاده میشود. این تکرر یک آنالوگ گلوکز است که توسط سلولهای استفادهکننده از گلوکز و فسفریله شده توسط hexokinase (که فرم میتوکندری خود را در تومورهای بدخیم به سرعت در حال رشد افزایش مییابد) گرفته شدهاست. دوز معمولی FDG مورد استفاده در اسکن انکولوژیک یک دوز مؤثر 14 mSv دارد[۸] از آنجا که اتم اکسیژن که توسط F-18 جایگزینی برای تولید FDG برای مرحله بعدی متابولیسم گلوکز در همه سلولها نیاز است، واکنشهای بیشتری در FDG رخ نمیدهد. علاوه بر این، اکثر بافتها (به استثنای کبد و کلیه قابل توجه است) نمیتوانند فسفات اضافه شده توسط هگزوکیناز را حذف کنند. این بدان معنی است که FDG در هر سلولی که تا زمان رسیدن آن به طول میانجامد، به دام افتادهاست، زیرا قندهای فسفریلیک شده به دلیل شارژ یونی آنها نمیتوانند از سلول خارج شوند. این نتایج رادیواکتیویته بافتهای با جذب گلوکز بالا مانند مغز طبیعی، کبد، کلیهها و اکثر سرطانها را نشان میدهد. در نتیجه، FDG-PET میتواند برای تشخیص، تنظیم و نظارت بر درمان سرطانها، به ویژه در لنفوم هوچکین، لنفوم غیر هودکین و سرطان ریه استفاده شود. چند ایزوتوپ دیگر و رادیوتراپیها به علت اهداف خاص انکولوژی معرفی میشوند. به عنوان مثال، متادومات [11C] با برچسب (11C-metomidate) برای تشخیص تومورهای منشأ آدرنوکورتیک استفاده شدهاست.[۹][۱۰] همچنین، FDOPA PET / CT (یا F-18-DOPA PET / CT) در مراکزی که آن را ارائه میدهند، جایگزینی حساستر برای پیدا کردن و همچنین موضعگیری فئوکروموسیتوما نسبت به اسکن MIBG است.[۱۱][۱۲][۱۳]
تصویربرداری عصبی
[ویرایش]
عصبشناسی: تصویر برداری عصبی PET مبتنی بر یک فرضیه است که مناطقی از رادیواکتیویت بالا با فعالیت مغز مرتبط است. غالباً بهطور غیرمستقیم اندازهگیری جریان خون به قسمتهای مختلف مغز که بهطور کلی اعتقاد بر آن همبستگی است و با استفاده از تریسیکس اکسیژن ۱۵ اندازهگیری شدهاست. به دلیل نیمه عمر ۲ دقیقه، O-15 باید بهطور مستقیم از یک سیکلوترون پزشکی استفاده شود که دشوار است. در عمل، از آنجا که مغز بهطور معمول یک کاربر سریع از گلوکز است و از آنجایی که آسیب مغزی مانند بیماری آلزایمر به میزان قابل توجهی متابولیسم مغز گلوکز و اکسیژن را در کنار هم کاهش میدهد، FDG-PET استاندارد مغز، که میزان مصرف گلوکز را اندازهگیری میکند، همچنین ممکن ��ست با موفقیت مورد استفاده قرار گیرد تا بیماری آلزایمر را از دیگر فرایندهای دمانس تشخیص دهد و همچنین تشخیص زودهنگام بیماری آلزایمر. مزیت FDG-PET برای این کاربردها بسیار وسیع است. تصویربرداری PET با FDG همچنین میتواند برای تعیین محل تمرکز تشنج استفاده شود: تمرکز تشنج در طول اسکن اینترتیال به عنوان هیوم متابولیک ظاهر میشود.
- عصبشناسی: علوم اعصاب شناختی: برای بررسی ارتباط بین فرایندهای خاص روانشناختی یا اختلالات و فعالیت مغز.
- روانپزشکی: ترکیبات متعددی که به صورت غیر اختصاصی به روانپزشکان بیولوژیک وابسته هستند، با C-11 یا F-18 تشخیص داده شدهاند. گیرندههای اپیدمی (mu) و دیگر سایتها با موفقیت در مطالعات با استفاده از رادیولایگندهایی که به گیرندههای (دوپامین (D1، D2،[۱۴][۱۵] گیرنده مجدد جذب میشوند، گیرندههای سروتونین (5HT1A، 5HT2A، گیرنده مجدد واکنش پذیر) افراد انسانی مطالعات انجام شده در حال بررسی وضعیت این گیرندهها در بیماران نسبت به کنترلهای سالم در اسکیزوفرنیا، سوء مصرف مواد، اختلالات خلقی و سایر شرایط روحی است.
- جراحی استریوتاکتیک و رادیو جراحی: جراحی هدایت شده با PET، درمان تومورهای داخل جمجمه، بیماریهای شریانی وریدی و سایر شرایط قابل درمان جراحی را تسهیل میکند.[۱۶]
قلبشناسی
[ویرایش]آترواسکلروز و بررسی بیماریهای عروقی: در کاردولوژی بالینی، FDG-PET میتواند به اصطلاح «خلع سلاح میوکارد» را شناسایی کند، اما هزینه آن در این نقش در مقایسه با SPECT مشخص نیست. تصویربرداری FDG-PET از آترواسکلروز برای تشخیص بیماران مبتلا به سکته مغزی نیز امکانپذیر است و میتواند به اثربخشی درمانهای ضد آترواسکلروز جدید کمک کند.[۱۷]
بیماریهای عفونی
[ویرایش]عفونتهای تصویربرداری با فناوریهای تصویربرداری مولکولی میتواند تشخیص و پیگیری درمان را بهبود بخشد. PET برای تشخیص عفونتهای باکتریایی بهطور بالقوه با استفاده از فلورودسو گلوکوز (FDG) برای شناسایی پاسخ التهابی مرتبط با عفونت بهطور گستردهای مورد استفاده قرار گرفتهاست.
فارماکوکینتیک: در آزمایشها قبل از بالینی، ممکن است یک داروی جدید را به وسیله رادیو نشان داده و آن را به حیوانات تزریق کند. چنین اسکنهایی به عنوان مطالعات انتشار بیولوژیکی نامیده میشود. جذب دارو، بافتهایی که در آن متمرکز میشود و از بین بردن آن، میتواند بسیار سریع تر و مؤثرتر از روش قدیمی تر کشتار و تخریب حیوانات برای کشف اطلاعات مشابه، نظارت شود. بیشتر بهطور معمول، مصرف مواد مخدر در یک محل مشخص شده از عمل میتواند بهطور غیرمستقیم توسط مطالعات رقابت بین داروهای بدون برچسب و ترکیبات مولد شناخته شده آپریوری به اتصال با خاصیت به سایت منعکس شدهاست. یک رادیولینگ تنها میتواند برای آزمایش بسیاری از نامزدهای احتمالی دارو برای یک هدف مورد استفاده قرار گیرد. یک روش مرتبط با آن شامل اسکن کردن با رادیولیگندها میباشد که با یک گیرنده داده شده با یک ماده درونزا (طبیعی) رقابت میکنند تا نشان دهند که یک داروی باعث آزاد شدن ماده طبیعی میشود.[۱۸]
ایمنی
[ویرایش]اسکن پت غیر تهاجمی است، اما این روش شامل قرار گرفتن در معرض اشعه یونیزاسیون است.[۶]
18F-FDG، که در حال حاضر رادیوتراپی استاندارد مورد استفاده برای تصویربرداری PET و مدیریت سرطان بیماران مبتلا به سرطان است،[۱۹] دوز مؤثر ۱۴ MSV دارد
مقدار تابش در 18F-FDG مشابه دوز مؤثر یک ساله در شهر آمریکایی دنور، کلرادو (12.4 mSv / year) است.[۲۰] برای مقایسه، دوز تابش برای سایر روشهای پزشکی از 0.02 mSv برای یک اشعه ایکس قفسه سینه و 6.5-8 mSv برای CT اسکن قفسه سینه است.[۲۱][۲۲] متوسط هواپیماهای مدنی در معرض 3 mSv / year قرار دارد[۲۳] و کل حد مجاز کار شغلی برای کارگران انرژی هسته ای در ایالات متحده آمریکا 50mSv / year است.[۲۴] برای مقیاس، سفارشهای از قدر (پرتو) را ببینید.
برای PET-CT اسکن، قرار گرفتن در معرض تابش ممکن است قابل توجه باشد- حدود 23-26 mSv (برای ۷۰ کیلوگرم دوز فردی احتمالاً بالاتر خواهد بود برای وزن بدن بالاتر)[۲۵]
عملکرد
[ویرایش]رادیونوکلئید و ردیاب پرتویی
[ویرایش]
رادیونوکلئیدهایی که در اسکن پت استفاده میشوند، معمولاً ایزوتوپها با نیمه عمر کوتاه مانند کربن ۱۱ (~ ۲۰ دقیقه)، نیتروژن ۱۳ (~ ۱۰ دقیقه)، اکسیژن ۱۵ (~ ۲ دقیقه)، فلوئور ۱۸ (~ ۱۱۰ دقیقه)، گالیم ۶۸ (~ ۶۷ دقیقه)، زیرکونیم ۸۹ (~ ۷۸٫۴۱ ساعت)،[۲۶] یا روبیدیوم ۸۲ (~ ۱٫۲۷ دقیقه). این رادیونوکلئیدها یا به ترکیباتی که بهطور طبیعی توسط بدن مورد استفاده قرار میگیرند مانند گلوکز (یا آنالوگهای گلوکز)، آب یا آمونیاک یا مولکولهایی که به گیرندهها یا سایر سایتهای فعالیت دارویی متصل میشوند، متصل میشوند. چنین ترکیبات برچسب دار به عنوان رادیوتراپی شناخته میشوند. فناوری PET میتواند برای ردیابی مسیر بیولوژیکی هر ترکیب در انسانهای زنده (و همچنین بسیاری از گونههای دیگر) نیز مورد استفاده قرار گیرد، در صورتی که با ایزوتوپ PET قابل تشخیص باشد؛ بنابراین، فرایندهای خاصی که میتوانند با PET مورد بررسی قرار گیرند، عملاً بیحد و حصر هستند و رادیوتراپی برای مولکولهای هدف و فرایندهای جدید همچنان سنتز میشود؛ همانطور که از این نوشتار، در حال حاضر دهها تن در استفاده بالینی و صدها مورد استفاده در تحقیقات وجود دارد. در حال حاضر [هنگامی که] رادیوتراپی رایجترین در پت اسکن بالینی پلاسما فلورایدوکسو گلوکوز (همچنین به نام FDG یا فلوتیکسی گلوکز)، یک آنالوگ از گلوکز است که با فلورین ۱۸ برچسب گذاری میشود. این رادیوتراپی در اصل همه اسکن برای انکولوژی و اکثر اسکن در مغز اعصاب استفاده میشود و در نتیجه اکثریت کل رادیوتراپی (> ۹۵٪) مورد استفاده در اسکن PET و PET را تشکیل میدهد. با توجه به نیمه کوتاه عمر اکثر رادیو ایزوتوپهای پرتوی پوزیترون، رادیوتراپیها بهطور سنتی با استفاده از یک سیکلوترون در نزدیکی دستگاه تصویربرداری PET تولید میشوند. نیمه عمر فلوئور ۱۸ به اندازه کافی بلند است که رادیوتراپیهایی که دارای فلوئور ۱۸ میباشند میتوانند به صورت تجاری در محلهای خارج از محل تولید شوند و به مراکز تصویربرداری منتقل شوند. اخیراً ژنراتورهای روبیدیوم ۸۲ به صورت تجاری در دسترس بودهاند. اینها حاوی استرانسیم ۸۲ هستند که با جذب الکترون برای تولید روتادیوم-۸۲ انتشار پوزیترون فرو میریزند.
انتشار
[ویرایش]
برای انجام اسکن، یک ایزوتوپ تریسی رادیواکتیو کوتاه مدت به موضوع زندگی تزریق میشود (معمولاً به گردش خون). هر اتم ردیاب شیمیایی به یک مولکول فعال زیست شناختی تبدیل شدهاست. یک دوره انتظار وجود دارد در حالی که مولکول فعال در بافتها متمرکز میشود؛ سپس موضوع در اسکنر تصویربرداری قرار میگیرد. مولکول که برای این منظور بیشتر مورد استفاده قرار میگیرد، فلوئوریدسوکسی گلوکز (FDG)، یک قند F-18 است که مدت زمان انتظار آن یک ساعت است. در حین اسکن، یک رکورد غلظت بافت به عنوان کشش تریسی ایجاد میشود.
همانطور که رادیو ایزوتوپ تحت تجزیه انتشار پوزیترون (همچنین به عنوان بتا مثبت شناخته میشود)، پوزیترون، یک ضد عنصر الکترون با شار مخالف را منتشر میکند. پوزیترون منتشر شده در بافت برای یک فاصله کوتاه (معمولاً کمتر از ۱ میلیمتر است اما وابسته به ایزوتوپ است)[۲۷] سفر میکند، که در آن زمان انرژی جنبشی را از دست میدهد، تا زمانی که به نقطهای که میتواند با الکترون ارتباط برقرار کند، تأخیر کند.[۲۸] این برخورد هر دو الکترون و پوزیترون را نابود میکند و یک جفت فوتونهای نابودکننده (گاما) ایجاد میکند که در جهت تقریباً مخالف حرکت میکنند. اینها هنگامی که آنها در یک دستگاه اسکن میرسند، ایجاد میشوند و موجب نوردهی میشوند که توسط فوتومولتیپایرها یا فوتودیوئیدها (سی APD) به دست میآید. این تکنیک به تشخیص همزمان یا همزمان دو فوتون که در جهت تقریباً مخالف حرکت میکند بستگی دارد (دقیقاً در مرکز محدودهٔ تودهٔ آنها کاملاً مخالف است، اما اسکنر هیچ راهی برای دانستن آن ندارد، و به همین جهت یک جهت کوچک ساخته شدهاست) فوتونهایی که به «جفت» های زمانی (به عنوان مثال در یک پنجره زمانی از چند نانو ثانیه) وارد نمیشوند، نادیده گرفته میشوند.
محلیسازی رویداد نابودی پوزیترون
[ویرایش]مهمترین بخش از تلفات الکترون-پوزیترون موجب میشود که دو فوتون گاما ۵۱۱ کیلووات در حدود تقریباً ۱۸۰ درجه به یکدیگر منتقل شوند؛ از این رو، ممکن است منبع خود را در کنار یک خط مستقیم از همپوشانی (که همچنین خط پاسخ یا LOR نامیده میشود) قرار دهیم. در عمل، LOR دارای عرضی غیر صفر است زیرا فوتونهای خروجی دقیقاً به فاصله ۱۸۰ درجه از یکدیگر فاصله ندارند. اگر زمان حل و فصل آشکارسازها کمتر از ۵۰۰ پیکوثانیه، به جای حدود ۱۰ نانو ثانیه باشد، ممکن است این رویداد را به یک بخش از وتر، که طول آن با وضوح زمانسنج آشکارساز تعیین میشود، قرار دهیم. با بهبود وضوح زمان، نسبت سیگنال به نویز (SNR) تصویر بهبود خواهد یافت و نیاز به رویدادهای کمتر برای دستیابی به همان کیفیت تصویر است. این تکنولوژی هنوز معمول نیست، اما در برخی از سیستمهای جدید موجود است.[۲۹]
روشهای آماری، رویکردهای مبتنی بر احتمال
[ویرایش]آماری، احتمال مبتنی بر الگوریتمهای تکرار انتظار-حداکثر سازی مانند الگوریتم شپ-واردی در حال حاضر روش ترجیحی بازسازی است.[۳۰][۳۱] این الگوریتمها برآورد توزیع احتمالی حوادث نابودی را محاسبه میکنند که به دادههای اندازهگیری شده بر اساس اصول آماری منجر میشود. مزیت پروفیل نویز بهتر و مقاومت در برابر مصنوعات رگه ای است که با FBP معمول است، اما ضرورت این است که نیازهای منابع کامپیوتر بالا باشد. یک مزیت دیگر از تکنیکهای بازسازی تصویر آماری این است که اثرات فیزیکی که باید قبل از اصلاح برای استفاده از الگوریتم بازنگری تحلیلی مانند فوتونهای پراکنده، اتفاقهای تصادفی، انقباض و آشکارساز زمان ماندگار، به احتمال زیاد مدل مورد استفاده در بازسازی، اجازه میدهد برای کاهش سر و صدای اضافی. نشان داده شدهاست که بازسازی واقعی، منجر به پیشرفت در حل و فصل تصاویر بازسازی شده میشود، از آنجا که مدلهای پیچیدهتر فیزیک اسکنر میتواند در مدل احتمال بیشتر از آنچه که توسط روشهای بازسازی تحلیلی استفاده میشود، امکانسنجی بهبود یافته توزیع رادیواکتیویته را افزایش دهد.[۳۲]
تصحیح تضعیف
[ویرایش]تصویربرداریPET نیاز به اصلاح ضخامت دارد[۳۳] در این سیستم تصحیح تضعیف براساس اسکن انتقال با استفاده از منبع میله چرخش 68Ge است[۳۴]
اسکنهای انتقال بهطور مستقیم اندازهگیریهای ولتاژ را در ۵۱۱ کیلو V اندازهگیری میکند.[۳۵] تضعیف زمانی رخ میدهد که فوتونهایی که توسط رادیوتراپی درون بدن منتشر میشوند، توسط بافت مداوم بین آشکارساز و انتشار فوتون جذب میشوند. همانطور که LORهای مختلف باید با ضخامتهای مختلفی از بافت عبور کنند، فوتونها به صورت متفاوتی تضعیف میشوند. نتیجه این است که سازههای عمیق در بدن به عنوان داشتن جذابیت ضعیف ضعیف بازسازی میشوند. اسکنرهای معاصر میتوانند با استفاده از یک تجهیزات CT-X یکپارچه، برآورد کنند، که یک فرم خام CT را با استفاده از یک منبع گاما (منبع پوزیترون) و آشکارسازهای PET، ارائه داد.
در حالی که تصاویر تصحیح شده با ضخامت عمدتاً بازنمایی وفادارتر است، فرایند تصحیح خود را حساس به مصنوعات برجسته میکند. در نتیجه، هر دو تصحیح و اصلاح نشده تصاویر همیشه بازسازی و خواندن با هم.

ترکیب PET با CT یا MRI
[ویرایش]
اسکن PETها در کنار اسکن سیگنالهای مغناطیسی یا رزونانس مغناطیسی (MRI)، با ترکیب به اطلاعات هر دو آناتومیک و متابولیکی (یعنی آنچه که ساختار است و آنچه که آن را بیوشیمیایی انجام میدهد) خوانده میشود. از آنجا که تصویربرداری PET در ترکیب با تصویربرداری آناتومیکی مفید است، مانند CT، اسکنرهای PET مدرن اکنون با CT Scanners چند منظوره پیشرفته (به اصطلاح PET-CT) در دسترس هستند. از آنجا که دو اسکن میتواند در یک جلسه فوری در همان جلسه انجام شود و بیمار موقعیت بین دو نوع اسکن را تغییر نمیدهد، دو مجموعه تصاویر دقیق تر ثبت میشوند، به طوری که مناطق ناهنجاری در تصویربرداری PET میتوانند بیشتر باشد کاملاً با آناتومی در تصاویر سی تی ارتباط دارد. این بسیار مفید است در ارائه دیدگاههای دقیق از حرکت دادن اندامها یا ساختارها با تغییرات آناتومیکی بالاتر، که بیشتر در خارج از مغز اتفاق میافتد. در مؤسسه بیولوژی و بیوفیزیک ژولیچ، بزرگترین دستگاه PET MRI جهان در آوریل ۲۰۰۹ شروع به کار کرد: یک توموگرافی رزونانس مغناطیسی ۹٫۴ تسلی (MRT) همراه با توموگرافی انتشار پوزیترون (PET). در حال حاضر، فقط مغز را میتوان در این میدانهای مغناطیسی بالا اندازهگیری کرد.[۳۶] برای تصویربرداری از مغز، ثبت نام CT, MRI و اسکن PET میتواند بدون نیاز به یک PET CT یا PET-MRI با استفاده از دستگاه شناخته شده به عنوان N-لوکالیزه انجام شود.[۱۶][۳۷][۳۸][۳۹]
محدودیتها
[ویرایش]حداقل رساندن دوز تابش به موضوع، جذابیت استفاده از رادیونوکلئیدهای کوتاه مدت است. در کنار نقش تعیین شده خود به عنوان یک تکنیک تشخیصی، PET به عنوان یک روش برای ارزیابی پاسخ به درمان، به ویژه درمان سرطان[۴۰] نقش گستردهای دارد.
محدودیت استفاده گسترده از PET ناشی از هزینههای بالا cyclotrons مورد نیاز برای تولید رادیونوکلئیدهای کوتاه مدت برای اسکن پت و نیاز به دستگاه سنتز شیمیایی در محل مناسب برای تولید رادیو داروها پس از آمادهسازی رادیوایزوتوپ. مولکولهای رادیوتراپی Organic که یک رادیو ایزوتوپ رادیویی پوزیترون را شامل میشوند ابتدا سنتز نمیشوند و سپس رادیوایزوتوپ درون آنها تهیه میشود، زیرا بمباران با یک سیکلوترون برای تهیه رادیوایزوتوپ، هر وسیله ای برای نگهداری آن را از بین میبرد. در عوض، ایزوتوپ باید ابتدا آماده شود، سپس پس از آن، شیمی برای آمادهسازی هر رادیوتراپی آلی (مانند FDG) بسیار سریع انجام میشود، در زمان کوتاهی قبل از انحلال ایزوتوپ. تعداد کمی از بیمارستانها و دانشگاهها قادر به حفظ چنین سیستمهایی هستند و اکثر PETهای بالینی توسط تأمینکنندگان شخص ثالث رادیوتراپی پشتیبانی میشوند که میتوانند همزمان چندین سایت را تأمین کنند. این محدودیت PET را در درجه اول به استفاده از ردیابهای برچسب دار شده با فلوئور ۱۸ محدود میکند، که نیمه عمر ۱۱۰ دقیقه را دارد و میتوان از راه دور معقول استفاده کرد یا به روبیدیوم ۸۲ (که به عنوان روبیدیم -۸۲ کلرید استفاده میشود) با نیمه عمر ۱٫۲۷ دقیقه است که در یک ژنراتور قابل حمل تولید میشود و برای مطالعات پرفوریونی قلب استفاده میشود. با این وجود، در سالهای اخیر چندین سیکلوترون در محل با محافظ یکپارچه و «آزمایشگاههای داغ» (آزمایشگاههای شیمی اتوماتیک که قادر به کار با رادیوایزوتوپها هستند) شروع به همراه کردن واحدهای PET به بیمارستانهای راه دور کردهاند. حضور کوچک سیکلوترون در محل، وعده داده که در آینده به عنوان سیکلووترنها در پاسخ به هزینه بالای حمل و نقل ایزوتوپ به دستگاههای PET کاهش یابد.[۴۱] در سالهای اخیر کمبود اسکنهای PET در ایالات متحده کاهش یافتهاست، چرا که انتشار داروهای رادیو ایزوتوپ برای تأمین رادیو ایزوتوپها ۳۰٪ در سال افزایش یافتهاست.[۴۲]
تاریخچه
[ویرایش]پت اسکن اول بار در دانشگاه واشینگتن در سنت لوییس در سال ۱۹۷۵ توسط مایکل فلپس اختراع شد.[۴۳] در این سیستم یک عنصر رادیواکتیو با نیمه عمر کوتاه که با گرفتن پوزیترون متلاشی میشود (که به لحاظ شیمیایی مولکول فعال متابولیک محسوب میشود) به بدن بیمار تزریق میگردد و پس از وقفه کوتاهی (جهت پخش مواد در سیستم گردش بدن) بیمار جهت تصویرگیری به داخل دستگاه اسکن منتقل میشود. مولکولی که بدین منظور استفاده میشود فلوئورو دی اکسی گلوکز (FDG-۱۸) میباشد.
امروزه دستگاههای پت در بیمارستانها در سرتاسر ایالات متحده و نیز در آشکارسازی و تحقیقات در زمینههایی همچون ناراحتیهای مغز و اعصاب مثل روانگسیختگی، پارکینسون، آلزایمر، و آنکولوژی کاربرد وسیع دارند.
در سال ۲۰۲۰ ایران حداقل سه دستگاه پت اسکن مشغول به کار دارد، که یکی در بیمارستان مسیح دانشوری، و دیگری در بیمارستان دکتر شریعتی و در بیمارستان خاتم الانبیا قرار دارند.[۴۴]
هزینه
[ویرایش]از اوت سال ۲۰۰۸، مراقبهای سرطانی انتاریو گزارش میدهد که هزینههای افزایشی در حال حاضر برای انجام اسکن PET در استان میتواند ۱۰۰۰ تا ۲۰۰ دلار برای هر اسکن باشد. این شامل هزینه دارو رادیو اکتیو و مصارف پزشک برای خواندن اسکن است.[۴۵]
در انگلستان، هزینه مرجع (NHS (2015-2016 برای یک اسکن سرپایی ۷۹۸ پوند و ۲۴۲ پوند برای خدمات دسترسی مستقیم است.[۴۶] در استرالیا، از ژوئیه ۲۰۱۸، هزینه برنامههای مزایای Medicare برای کل بدن FDG PET بین ۹۵ تا ۹۹ دلار است که بسته به نشانهای برای اسکن است.[۴۷]
نگارخانه
[ویرایش]-
شماتیک نحوهٔ عملکرد سیستم پت اسکن از زمان تلاشی جفتی تا زمان نمایش بر صفحه رایانه
-
یک دستگاه پت-سی تی ترکیبی
-
نتیجهٔ ترکیب سیستمهای پت و سی تی اسکن تصویر ساختاری-دگرگشتی بالا میباشد.
-
شماتیک چگونگی آشکارسازی تصادفی در PET
جستارهای وابسته
[ویرایش]منابع
[ویرایش]- ↑ Bailey DL, Townsend DW, Valk PE, Maisy MN (2005). Positron Emission Tomography: Basic Sciences. Secaucus, NJ: Springer-Verlag. ISBN 978-1-85233-798-8.
- ↑ Zaucha JM, Chauvie S, Zaucha R, Biggii A, Gallamini A (July 2019). "The role of PET/CT in the modern treatment of Hodgkin lymphoma". Cancer Treatment Reviews. 77: 44–56. doi:10.1016/j.ctrv.2019.06.002. PMID 31260900. S2CID 195772317.
- ↑ McCarten KM, Nadel HR, Shulkin BL, Cho SY (October 2019). "Imaging for diagnosis, staging and response assessment of Hodgkin lymphoma and non-Hodgkin lymphoma". Pediatric Radiology. 49 (11): 1545–1564. doi:10.1007/s00247-019-04529-8. PMID 31620854. S2CID 204707264.
- ↑ Aldin A, Umlauff L, Estcourt LJ, Collins G, Moons KG, Engert A, et al. (Cochrane Haematology Group) (January 2020). "Interim PET-results for prognosis in adults with Hodgkin lymphoma: a systematic review and meta-analysis of prognostic factor studies". The Cochrane Database of Systematic Reviews. 1 (1): CD012643. doi:10.1002/14651858.CD012643.pub3. PMC 6984446. PMID 31930780.
- ↑ ۵٫۰ ۵٫۱ "Nuclear Medicine". hyperphysics.phy-astr.gsu.edu. Retrieved 2022-12-11.
- ↑ ۶٫۰ ۶٫۱ 1942-، Carlson, Neil R. ,. Physiology of behavior (ویراست Eleventh edition). Boston. OCLC 769818904. شابک ۹۷۸۰۲۰۵۲۳۹۳۹۹.
- ↑ Carlson, Neil (January 22, 2012). Physiology of Behavior. Methods and Strategies of Research. Vol. 11th edition. Pearson. p. 151. ISBN 978-0-205-23939-9.
- ↑ ۸٫۰ ۸٫۱ ۸٫۲ Paul E. Christian, et al. Nuclear Medicine and PET. Mosby Publishing. 2004. p.77
- ↑ Khan, Tanweera S.; Sundin, Anders; Juhlin, Claes; Långström, Bengt; Bergström, Mats; Eriksson, Barbro (2003-03). "11C-metomidate PET imaging of adrenocortical cancer". European Journal of Nuclear Medicine and Molecular Imaging. 30 (3): 403–410. doi:10.1007/s00259-002-1025-9. ISSN 1619-7070.
{{cite journal}}: Check date values in:|date=(help) - ↑ Någren, K.; Yu, M.; Roivainen, A.; Friberg, J.; Nuutila, P.; Minn, H.; Fasth, K. -J.; Långström, B. (2001-05). "Radioactive metabolites of the 11β-hydroxylase pet tracer [11C]metomidate measured by HPLC analysis of plasma samples during human pet studies". Journal of Labelled Compounds and Radiopharmaceuticals. 44 (S1): S468–S470. doi:10.1002/jlcr.25804401165. ISSN 0362-4803.
{{cite journal}}: Check date values in:|date=(help) - ↑ Yee, R.E.; Irwin, I.; Milonas, C.; Stout, D.B.; Huang, S-C.; Shoghi-Jadid, K.; Satyamurthy, N.; Delanney, L.E.; Togasaki, D.M. (2001-08-30). "Novel observations with FDOPA-PET imaging after early nigrostriatal damage". Movement Disorders. 16 (5): 838–848. doi:10.1002/mds.1168. ISSN 0885-3185.
- ↑ "Seismic Imaging, Overview". SpringerReference. Berlin/Heidelberg: Springer-Verlag.
- ↑ Luster, Markus; Karges, Wolfram; Zeich, Katrin; Pauls, Sandra; Verburg, Frederik A.; Dralle, Henning; Glatting, Gerhard; Buck, Andreas K.; Solbach, Christoph (2009-10-28). "Clinical value of 18F-fluorodihydroxyphenylalanine positron emission tomography/computed tomography (18F-DOPA PET/CT) for detecting pheochromocytoma". European Journal of Nuclear Medicine and Molecular Imaging. 37 (3): 484–493. doi:10.1007/s00259-009-1294-7. ISSN 1619-7070.
- ↑ Mukherjee, Jogeshwar; Christian, Bradley T.; Dunigan, Kelly A.; Shi, Bingzhi; Narayanan, Tanjore K.; Satter, Martin; Mantil, Joseph (2002-09-25). "Brain imaging of18F-fallypride in normal volunteers: Blood analysis, distribution, test-retest studies, and preliminary assessment of sensitivity to aging effects on dopamine D-2/D-3 receptors". Synapse. 46 (3): 170–188. doi:10.1002/syn.10128. ISSN 0887-4476.
- ↑ BUCHSBAUM, M; CHRISTIAN, B; LEHRER, D; NARAYANAN, T; SHI, B; MANTIL, J; KEMETHER, E; OAKES, T; MUKHERJEE, J (2006-07). "D2/D3 dopamine receptor binding with [F-18]fallypride in thalamus and cortex of patients with schizophrenia". Schizophrenia Research. 85 (1–3): 232–244. doi:10.1016/j.schres.2006.03.042. ISSN 0920-9964.
{{cite journal}}: Check date values in:|date=(help) - ↑ ۱۶٫۰ ۱۶٫۱ Levivier، M.؛ Massager، N.؛ Wikler، D.؛ Goldman، S. (۲۰۰۴). Modern Multimodal Neuroimaging for Radiosurgery: The Example of PET Scan Integration. Vienna: Springer Vienna. صص. ۱–۷. شابک ۹۷۸۳۷۰۹۱۷۲۰۰۱.
- ↑ Rudd, J.H.F.; Warburton, E.A.; Fryer, T.D.; Jones, H.A.; Clark, J.C.; Antoun, N.; Johnström, P.; Davenport, A.P.; Kirkpatrick, P.J. (2002-06-11). "Imaging Atherosclerotic Plaque Inflammation With [ 18 F]-Fluorodeoxyglucose Positron Emission Tomography". Circulation. 105 (23): 2708–2711. doi:10.1161/01.cir.0000020548.60110.76. ISSN 0009-7322.
{{cite journal}}: line feed character in|title=at position 51 (help) - ↑ Laruelle, Marc (2000-03). "Imaging Synaptic Neurotransmission within VivoBinding Competition Techniques: A Critical Review". Journal of Cerebral Blood Flow & Metabolism. 20 (3): 423–451. doi:10.1097/00004647-200003000-00001. ISSN 0271-678X.
{{cite journal}}: Check date values in:|date=(help) - ↑ Kelloff, G. J. (2005-04-15). "Progress and Promise of FDG-PET Imaging for Cancer Patient Management and Oncologic Drug Development". Clinical Cancer Research. 11 (8): 2785–2808. doi:10.1158/1078-0432.ccr-04-2626. ISSN 1078-0432.
- ↑ Italia، Peterzen, S. ; Italian Space Agency, Luigi Broglio Launch Facility, Trapani Romeo, G. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Di Stefano, G. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Masi, S. ; University of Rome La Sapienza, Physics Department, Rome Muso, I. ; Institute of Information Science and Technology, National Research Council, Pisa Drakøy, P. ; Andøya Rocket Range, Andenes, Norway Di Felice, F. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Ibba, R. ; Italian Space Agency, Luigi Broglio Launch Facility, Trapani Palangio, P. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Caprara, F. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Cardillo, A. ; Institute of Information Science and Technology, National Research Council, Pisa Spoto, D. ; Italian Space Agency, Luigi Broglio Launch Facility, Trapani Memmo, A. ; CETEMPS Center of Excellence, University of L’Aquila, L’Aquila Mari, M. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Iarocci, A. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Urbini, G. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Benedetti, P. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma, Italia Spinelli, G. ; Istituto Nazionale di Geofisica e Vulcanologia, Sezione Roma1, Roma,. PEGASO: LONG DURATION BALLOONS FROM NORTH POLE. OCLC 786203491.
- ↑ "Managing patient dose in computed tomography". Annals of the ICRP. 30 (4): 7–7. 2000-12. doi:10.1016/s0146-6453(01)00049-5. ISSN 0146-6453.
{{cite journal}}: Check date values in:|date=(help) - ↑ de Jong, Pim A.; Tiddens, Harm A.; Lequin, Maarten H.; Robinson, Terry E.; Brody, Alan S. (2008-05). "Estimation of the Radiation Dose From CT in Cystic Fibrosis". Chest. 133 (5): 1289–1290. doi:10.1378/chest.07-2840. ISSN 0012-3692.
{{cite journal}}: Check date values in:|date=(help) - ↑ «Original PDF». dx.doi.org. دریافتشده در ۲۰۱۹-۰۱-۲۷.
- ↑ None (1990-03-01). "Nuclear Regulatory Commission information digest".
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Noßke, D.; Leche, U.; Brix, G. (2014). "Radiation exposure of patients undergoing whole-body FDG-PET/CT examinations". Nuklearmedizin. 53 (05): 217–220. doi:10.3413/nukmed-0663-14-04. ISSN 0029-5566.
- ↑ "Radionuclide". Wikipedia (به انگلیسی). 2018-11-03.
- ↑ Quarantelli, Mario; Prinster, Anna (2007-01-23). "Michael E. Phelps (ed) PET: physics, instrumentation and scanners. Springer, New York, 2006, 130 pp, 77 illustrations. Hardcover. $59.95. ISBN 0-387-32302-3, ISBN 978-0-387-32302-2". European Journal of Nuclear Medicine and Molecular Imaging. 34 (5): 799–799. doi:10.1007/s00259-006-0353-6. ISSN 1619-7070.
- ↑ Quarantelli, Mario; Prinster, Anna (2007-01-23). "Michael E. Phelps (ed) PET: physics, instrumentation and scanners. Springer, New York, 2006, 130 pp, 77 illustrations. Hardcover. $59.95. ISBN 0-387-32302-3, ISBN 978-0-387-32302-2". European Journal of Nuclear Medicine and Molecular Imaging. 34 (5): 799–799. doi:10.1007/s00259-006-0353-6. ISSN 1619-7070.
- ↑ Muzic, Raymond F.; Kolthammer, Jeffrey A. (2006). "PET Performance of the GEMINI TF: A Time-of-flight PET/CT Scanner". 2006 IEEE Nuclear Science Symposium Conference Record. IEEE. doi:10.1109/nssmic.2006.354274. ISBN 1-4244-0560-2.
- ↑ Carson, Richard E. (1986-07). "A Maximum Likelihood Method for Region-of-Interest Evaluation in Emission Tomography". Journal of Computer Assisted Tomography. 10 (4): 654–663. doi:10.1097/00004728-198607000-00021. ISSN 0363-8715.
{{cite journal}}: Check date values in:|date=(help) - ↑ Vardi, Y.; Shepp, L. A.; Kaufman, L. (1985-03). "A Statistical Model for Positron Emission Tomography". Journal of the American Statistical Association. 80 (389): 8–20. doi:10.1080/01621459.1985.10477119. ISSN 0162-1459.
{{cite journal}}: Check date values in:|date=(help) - ↑ Qi, Jinyi; Leahy, Richard M (2006-07-12). "Iterative reconstruction techniques in emission computed tomography". Physics in Medicine and Biology. 51 (15): R541–R578. doi:10.1088/0031-9155/51/15/r01. ISSN 0031-9155.
- ↑ Huang, Sung-Cheng; Hoffman, Edward J.; Phelps, Michael E.; Kuhl, David E. (1979-12). "Quantitation in Positron Emission Computed Tomography". Journal of Computer Assisted Tomography. 3 (6): 804–814. doi:10.1097/00004728-197912000-00018. ISSN 0363-8715.
{{cite journal}}: Check date values in:|date=(help) - ↑ Navalpakkam, Bharath K.; Braun, Harald; Kuwert, Torsten; Quick, Harald H. (2013-05). "Magnetic Resonance–Based Attenuation Correction for PET/MR Hybrid Imaging Using Continuous Valued Attenuation Maps". Investigative Radiology. 48 (5): 323–332. doi:10.1097/rli.0b013e318283292f. ISSN 0020-9996.
{{cite journal}}: Check date values in:|date=(help) - ↑ Wagenknecht, Gudrun; Kaiser, Hans-Jürgen; Mottaghy, Felix M.; Herzog, Hans (2012-11-21). "MRI for attenuation correction in PET: methods and challenges". Magnetic Resonance Materials in Physics, Biology and Medicine. 26 (1): 99–113. doi:10.1007/s10334-012-0353-4. ISSN 0968-5243.
- ↑ Bidmon, Hans-J; Speckmann, Erwin-J; Zilles, Karl J (2009). "Seizure Semiology, Neurotransmitter Receptors and Cellular-stress Responses in Pentylenetetrazole Models of Epilepsy". European Neurological Review. 4 (1): 76. doi:10.17925/enr.2009.04.01.76. ISSN 1758-3837.
- ↑ Tse، Victor C. K.؛ Kalani، M. Yashar S.؛ Adler، John R. (۲۰۱۵). Techniques of Stereotactic Localization. New York, NY: Springer New York. صص. ۲۵–۳۲. شابک ۹۷۸۱۴۶۱۴۸۳۶۲۵.
- ↑ Green, Dave (2014-12-08). "Stereotactic Radiosurgery and Stereotactic Body Radiation Therapy. Edited by Stanley H. Benedict, David J. Schlesinger, Steven J. Goetsch, Brian D. Kavanagh CRC Press, Taylor & Francis Group; ISBN 978-1-4398-4197-6; 395 pages; Hardback £79.20". Journal of Radiotherapy in Practice. 14 (01): 105–106. doi:10.1017/s146039691400048x. ISSN 1460-3969.
- ↑ Khan، Fahd R.؛ Henderson، Jaimie M. (۲۰۱۳). Deep brain stimulation surgical techniques. Elsevier. صص. ۲۷–۳۷. شابک ۹۷۸۰۴۴۴۵۳۴۹۷۲.
- ↑ Young, H.; Baum, R.; Cremerius, U.; Herholz, K.; Hoekstra, O.; Lammertsma, A.A.; Pruim, J.; Price, P. (1999-12). "Measurement of clinical and subclinical tumour response using [18F]-fluorodeoxyglucose and positron emission tomography: review and 1999 EORTC recommendations". European Journal of Cancer. 35 (13): 1773–1782. doi:10.1016/s0959-8049(99)00229-4. ISSN 0959-8049.
{{cite journal}}: Check date values in:|date=(help) - ↑ From James Madison, 15 September – From James Monroe, 12 November. Princeton: Princeton University Press. شابک ۹۷۸۱۴۰۰۸۴۰۰۳۸.
- ↑ «Original PDF». dx.doi.org. دریافتشده در ۲۰۱۹-۰۱-۲۹.
- ↑ Simon Cherry, et al. Physics in Nuclear Medicine. Saunders Publishing. 2003. p.۳
مایکل فلپس امروزه استاد دانشگاه UCLA است. مقاله اصلی که ایشان اول بار در این زمینه به چاپ رسانیدند عبارت است از:
Phelps ME, Hoffman EJ, Mullani NA, et al. Application of annihilation coincidence detection of transaxial reconstruction tomography. J Nucl Med 16:210-215, 1975. - ↑ «:: IRSNM :. : about us. :». بایگانیشده از اصلی در ۴ ژانویه ۲۰۱۰. دریافتشده در ۲ ژانویه ۲۰۱۰.
- ↑ "Positron Emission Tomography (PET) Imaging". SpringerReference. Berlin/Heidelberg: Springer-Verlag.
- ↑ "Grain Transportation Report, December 22, 2016". 2016-12-22.
{{cite journal}}: Cite journal requires|journal=(help) - ↑ Malatzky, Christina; Glenister, Kristen (2018-10-11). "Talking about overweight and obesity in rural Australian general practice". Health & Social Care in the Community. doi:10.1111/hsc.12672. ISSN 0966-0410.