تصویرسازی مولکولی
تصویرسازی مولکولی (به انگلیسی: Molecular imaging) به روشی گویند که بهطور مستقیم و غیرمستقیم توزیع فضایی و زمانی فرایندهای مولکولی و سلولی را برای کاربردهای زیست-شیمی، زیست شناسی، تشخیصی یا درمانی بررسی و ثبت میکند.[۱]
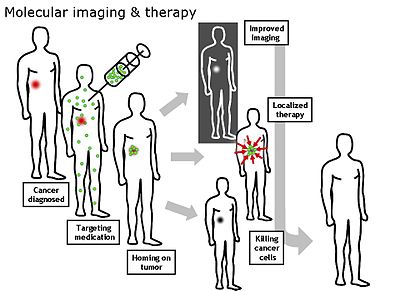
توانایی ردیابی مولکولهایی خاص در مکانهای مشخص آناتومیک در موجودات زنده، تصویربرداری مولکولی نامیده میشود. تصویربردای مولکولی میتواند در شناخت مسیرهای متابولیک، ساختار بافتها و مطالعه حیوانات کوچک به کار گرفته شود. در این نوع تصویربرداری هدف مطالعه در سطح مولکولی و حتی زیرمولکولی به صورت غیرتهاجمی و بدون آسیب رساندن به موجود زنده است. از تواناییهای این نوع از تصویربرداری میتوان در تشخیص و حتی درمان برخی از بیماریها همچون سرطان و بیماریهای قلبی عروقی استفاده کرد.
همچنین این تکنیک میتواند برای بهبود روشهای درمان و بهینهسازی داروها در آزمایشهای پیشکلینیکی و سپس کاربردهای کلینیکی استفاده شود.
از سوی دیگر استفاده از این نوع تصویربرداری در آینده میتواند توجیهات اقتصادی زیادی را به دنبال داشته باشد چرا که با تلفیق تصویربرداری مولکولی و عملکردی، در کنار علم ژنتیک، میتوان راههای درمان کمهزینهتر و کاراتری را بدست آورد.
در تصویربرداری مولکولی از پروبهایی به نام بیومارکر استفاده میشود که امکان شناسایی بخش خاصی را فراهم میسازند. این مواد با محیط اطراف خود واکنش میدهند و از اثرات این واکنش در تصویرسازی استفاده میشود. همانطور که میدانیم در تصویربرداری عادی معمولاً تغییراتی مانند تغییر در غلظت یا تراکم بیشتر مورد توجه بودهاست.
امروزه زمینههای تحقیقاتی بسیاری در ارتباط با تصویربرداری مولکولی هستند. بسیاری از پژوهشها به دنبال یافتن راهی برای تشخیص زود هنگام بیماریها با توجه به آرایش مولکولها پیش از بروز نشانههای معمول بیماری هستند. بخش دیگری از تحقیقات بر مطالعه ژنها برای یافتن بیومارکرهای جدید تمرکز دارند.
بخش مهمی از تصویربرداری مولکولی به تصویربرداری از حیوانات کوچک اختصاص یافتهاست. از آنجا که استفاده از حیوانات کوچک در تحقیقات در حال گسترش است، اهمیت تصویربرداری از آنها افزایش مییابد. این نوع از تصویربرداری در درجه اول باید از قدرت تفکیک مکانی بالا برخوردار باشد که مکانیابی مناسب در حیوان ممکن شود و در درجه دوم از حساسیت بالا برخوردار باشد که بتواند نحوه توزیع مولکولها و تمرکز آنها را به خوبی گزارش کند. از آنجا که موشها مدلی مناسب با ویژگیهایی نزدیک به ساختار بدن انسان هستند، بیشترین طیف تصویربرداری مولکولی از حیوانات را به خود اختصاص دادهاند.
مطالعه مشکلات قلبی و عروقی در موشها هدف مطالعه تصویربرداری هستهای بودهاست. این مطالعات کارکردهای دو سویه داشتهاند بدین معنی که از طرفی با استفاده از مدالیتههای موجود در تصویربرداری معمولی و بهینهسازی آنها برای کار در ابعاد کوچک، کار تصویربرداری از حیوانات صورت گرفتهاست و از طرف دیگر از یافتههای موجود در این دستگاههای بهینه شده، برای بهبود تصویربرداری کلینیکی دوباره استفاده شدهاست. در مواردی از پروبهایی که برای حیوانات ساخته شده نیز در کاربردهای کلینیکی استفاده گردیده است.[۲]
تاریخچه

استفاده از مواد رادیواکتیو به عنوان یک ردیاب بیولوژیکی اولین بار توسط جرج هوسی[۳] که در سال ۱۹۴۳ میلادی برنده جایزه نوبل شد، مطرح گردید. وی با توجه به ویژگیهای طیفی پرتو X توانست عنصر جدیدی را کشف کند. او تلاشهای خود را در کنار ارنست رادرفورد ادامه داد و توانست با تلفیق رادیوم و نوعی نمک سرب به یک نشانگر دست یابد. وی با استفاده از تعدادی آزمایش کلاسیک توانست نحوه توزیع سرب در نوعی لوبیا را مطالعه کند. به این ترتیب اولین ردیاب شکل گرفت. این آزمایشهای پایه اولیه پزشکی هستهای و سپس تصویربرداری مولکولی را شکل داد.
اولین مطالعات در زمینه ردیابها در بدن انسان توسط هرمان بلومگارت و همکارانش در سال ۱۹۲۵ میلادی در بوستون صورت گرفت. وی محلولی از رادیوم C را به بازوی راست بیمار تزریق کرد و با استفاده از محفظه ابری ویلسون، زمان رسیدن محلول به بازوی چپ را بدست آورد.
اولین استفاده کلینیکی در دهه ۱۹۴۰ میلادی صورت گرفت. در این آزمایش عملکرد غده تیروئید با استفاده از رادیو ایزوتوپ I-۱۳۱ بررسی شد. در کار اولیه از یک آشکارساز که بر روی گردن و ناحیه بالای سینه نصب شده بود استفاده گردید.
تصویربرداری مولکولی از حیوانات، در سالهای اولیه دهه ۱۹۹۰ میلادی توسط دانشمندانی از حوزههای مختلف علوم شکل گرفت. این موضوع با توجه به استفاده روز افزون از حیوانات کوچک به خصوص موشها در تحقیقات، ضرورت یافت. شاید بتوان گفت از میان مدالیتههای گوناگون تصویرگری پزشکی، اولین مدالیته مورد استفاده برای حیوانات PET بود. اولین مقطعنگاری توسط PET توسط مرکز هاماماتسو[۴] با استفاده از سیستم SHR-۲۰۰۰ صورت گرفت. سیستم دیگری که در ابتدا مورد استفاده قرار گرفت، ECAT-۷۱۳ بود که در دانشگاه UCLA نصب گردید. این سیستم از کریستالهای ۳۰*۶٫۲۵*۳٫۵ میلیمتر استفاده میکرد که در آرایهای ۸*۶ کنار هم قرار گرفته بودند و از دو تیوب PMT با میدان دید ۴٫۵ سانتیمتر بهره میبردند. این اسکنرها برای تصویربرداری دو بعدی طراحی شده بودند. سیستم SHR-۲۰۰۰ دارای دقت ۳٫۸ میلیمتر و سیستم ECAT-۷۱۳ دارای دقت ۴٫۲ میلیمتر در مرکز میدان دید بود. هاماماتسو سپس سیستم SHR-۷۷۰۰ را ساخت که از رزولوشن بالاتری بهره میبرد. وی توانست به دقت ۲٫۶ میلیمتر برسد.
کنکرد میکروسیستم[۵] در سال ۲۰۰۲ میلادی، آشکارسازی با چهار رینگ طراحی نمود که توانست به میدان دید ۸ سانتیمتر برسد. این مقدار میدان دید امکان تصویربرداری همزمان از یک موش کامل را فراهم ساخت. این سیستم با نام microPET P۴ معرفی گردید. در سال ۲۰۰۴ میلادی سیستم HIDAC ساخته شد که توانست با بهینهسازی ساختار آشکارسازها و کوچک کردن آنها به دقتی در حدود ۲ میلیمتر برسد.
در کنار این مدالیته، تقریباً تمام مدالیتههای رایج در تصویربرداری پزشکی، برای تصویربرداری از حیوانات کوچک بهکارگرفته و بهینهسازی شدهاند. همچنین استفاده از دو مدالیته گوناگون برای رسیدن به اهداف این تصویربرداری که داشتن قدرت تفکیک مکانی مناسب در کنار حساسیت بالاست، بکار گرفته شدهاند.
کاربردهای تصویربرداری مولکولی
امروزه استفاده از تصویربرداری مولکولی محدود به کاربردهای پیشکلینیکی و تحقیقاتی نیست بلکه روز به روز برکاربرد آنها در کارهای کلینیکی و درمانی افزوده میشود. در این زمینه میتوان به کاربرد تصویربرداری مولکولی در بیماریهای قلبی و عروقی، سرطان و اختلالات نورولوژیک اشاره کرد.
در مورد بیماریهای قلبی عروقی، تصویربرداری مولکولی امکان مطالعه دقیق و شخص به شخص بیماری و مدیریت آن را در مشکلاتی نظیر گرفتگی عروق، آریتمی، پس زدن عضو پیوندی، تشکیل لخته در عروق و ایست قلبی، فراهم میآورد. در ارتباط با سرطان، تصویربرداری مولکولی در کنار امکان مکانیابی دقیق تومور، میتواند ویژگیهایی از آن را مشخص سازد و سیر پیشرفت بیماری و متاستاز آن به نواحی مختلف بدن را بیان کند. در این بیماری، تصویربرداری مولکولی نقش مهمی در درمان و ارزیابی پاسخ بیمار به درمان ایفا میکند. به عنوان مثال از FDG به عنوان یک پروب مولکولی برای تشخیص سرطان لنف استفاده شدهاست. این فرایند از این موضوع استفاده میکند که سلولهای سرطانی با توجه به متابولیسم خود بهطور انتخابی با هکسوکیناز واکنش داده و دکسیگلوکز را به دام میاندازند. این واکنش نرخ انباشتگی FDG را نشان میدهد. بنابراین میتوان با PET FDG، استفاده گلوکز توسط سلولهای سرطانی را مطالعه نمود.
در مورد اختلالات نورولوژیک، تصویربرداری مولکولی نقش مهمی در تشخیص، طبقهبندی و ارزیابی درمان ایفا میکند. استفاده از این نوع تصویربرداری در کاربردهای گوناگون این نوع اختلالات، از مشکلات حرکتی در بیماری پارکینسون تا مشکلات روانی در آلزایمر رواج یافتهاست. از دیگر کاربردهای تصویربرداری مولکولی استفاده از آن در تشخیص بافتهایی است که دچار کمبود اکسیژن شدهاند. این مشکل در هنگام سکته و دیگر مشکلات قلبی یا بواسطه برخی از تومورها اتفاق میافتد. با رشد تومور، مقدار اکسیژن رسیده توسط عروق پاسخگوی نیاز آن نیست اما متأسفانه تومور با تغییراتی که در ساختار سلولها میدهد، میتواند خود را با این کمبود اکسیژن وفق دهد. این تغییرات مقاومت تومور در مقابل شیمیدرمانی را افزایش میدهد و بنابراین روند درمانی مناسب قابل انجام نخواهد بود. در دهه اخیر با استفاده از تصویربرداری مولکولی کارهای زیادی در زمینه تشخیص و درمان این مشکل صورت گرفتهاست.
از طرفی در کاربردهای پیشکلینیکی، تصویربرداری مولکولی زمینهساز بسیاری از پیشرفتها گردیده است. گرچه در اکثر مدالیتهها و تکنیکهای به کار گرفته شده تا امروز نیاز به بیهوش کردن حیوان میباشد، اما روند بررسی کاملاً غیرتهاجمی بوده و علاوه بر اطلاعات آناتومیک امکان استخراج اطلاعات عملکردی فراهم گردیده است. از جمله کاربردهای مهم در این زمینه تحلیل زمان واقعی نحوه پخش دارو در مدل حیوانی است. این موضوع از آنجایی اهمیت بیشتری مییابد که این تصویربرداری امکان دریافت اطلاعات تا سطح گیرندهها و مطالعه دینامیک آنها را نیز فراهم آوردهاست. استفاده از تصویربرداری مولکولی در ژندرمانی از دیگر کاربردهای آن است. ژندرمانی میتواند تحول بزرگی در درمان بیماریها ایجاد کند اما معضل مهم این است که بتوان ژنها را به بافت مورد نظر به صورت صحیح رساند. این موضوع اهمیت مانیتور کردن راه عبور دارو را مشخص میکند. این کار توسط تصویربرداری مولکولی به خوبی قابل انجام است. تاکنون مطالعات زیادی در موشها بر روی نانوذراتی صورت گرفتهاست که میتوانند همراه با ژنی خاص حرکت کنند و قابلیت استفاده در تصویرسازی را دارند. از ژندرمانی در مدلهای حیوانی برای درمان پارکینسون و انواع گوناگونی از سرطان استفاده شدهاست.
مدالیتههای مورد استفاده در تصویربرداری مولکولی

A. سیستم microPET، اسکن کامل از موش B. سیستم microCT اسکن شکم موش بعد از ردیاب ید C. سیستم microSPECT D. سیستم نوری فلورسنت، بازتاب فلورسنت از شش و شکم E. سیستم microMRI، تصویری از مغز موش F. سیستم نوری لومینانس
A. کل بدن موش B. دینامیک ضربان قلب C. میزان زوال ماده رادیو اکتیو در قلب و خون در طول زمان]]
در تصویربرداری مولکولی از بیشتر مدالیتههای موجود در تصویربرداری پزشکی استفاده میشود اما برای استفاده از آنها در ابعاد کوچک و رسیدن به ویژگیهای مطلوب، نیاز به بهینهسازی این مدالیتهها و تلفیق آنها وجود دارد. در حقیقت معمولاً تصویربرداری مولکولی یک تصویربرداری چند مدالیته[۶] است تا بتواند با استفاده از تکنیکهای موجود رزولوشن مناسب در کنار حساسیت بالا را فراهم آورد. از رایجترین ترکیبهای چند مدالیته میتوان به SPECT/CT و PET/MRI اشاره کرد.
در این گزارش به بررسی مدالیتههای زیر در ارتباط با تصویربرداری مولکولی پرداخته میشود:
- PET
- MRI
- PET/MRI
- SPECT
- CT
PET
در این مدالیته برای تصویرگری از تشعشع پوزیترونی استفاده میشود. مزیت بسیار مهم این روش حساسیت بالای آن است که امکان تصویربرداری از نقاط مشخص را میدهد. فوتونهای تولیدی از تشعشع پوزیترونی دارای انرژی بالایی هستند و این موضوع باعث میشود که حساسیت این روش از SPECT بالاتر رود. در سیستم SPECT از پرتوهای گاما استفاده میشود که انرژی کمتری نسبت به پوزیترونها دارند.
یکی از مزیتهای مهمی که سیستم PET فراهم میآورد وجود امکان اندازهگیری کمی فرایندهای بیولوژیکی است که دارای تشعشع پوزیترون ۱۸F و ۱۱C هستند. به این ترتیب این مدالیته میتواند به عنوان مثال نمودار افزایش و کاهش حجم قلب یک موش را بدست دهد.
در روش PET هنگام بازسازی تصویر معمولاً از دو روش استفاده میشود:
- مد فریمی: در این روش آدرس هر پیکسل از قبل در حافظه کامپیوتر مشخص است. هر جرقه آشکارسازها باعث اضافه شدن عددی به اشارهگر آدرس حافظه شده و پیکسل متناسب با مکان کریستال روشن میشود.
- مد لیستی: در این روش هر جرقه مرتبط با آدرس حافظه خودش است.
در صورت استفاده از مد لیستی، PET میتواند تصاویر تقریباً زمان واقعی تولید کند که توانایی نشان دادن دینامیک فرایندها را دارند. برای دستیابی به رزولوشن زمانی بالاتر برای دنبال کردن ردیاب، از آشکارسازهای لانتانیم برومید به همراه تکثیرگر نوری استفاده میشود.
در کنار مزایای گفته شده، PET از قدرت تفکیک مکانی مناسب نسبت به ابعاد کوچک موش، بهره نمیبرد. گرچه این سیستم دارای محدودکننده اساسی (۰٫۲ تا ۰٫۳ میلیمتر برای ایزوتوپهای ۱۸F و ۱۱C) است، اما عامل اصلی این محدودیت مربوط به تکنولوژی ساخت آشکارسازهای PET است. به این منظور در آشکارسازهای نسل جدید، هدف رسیدن به SNR و حساسیت بیشتر و در کنار آن رزولوشن بهتر است. به این منظور آشکارسازهایی با قطر کمتر و طول بیشتر به شکل مخروطی ساخته شدهاند که هم بتوان تعداد بیشتری از آنها را در کنار هم قرار داد و هم زمان بیشتری برای به دام انداختن و آشکارسازی تشعشع دریافت شده وجود داشته باشد و قدرت جذب آشکارساز بالا رود. این آشکاسازها دارای میدان دید کمتری هستند. محققان در نسلهای آینده به دنبال رسیدن به آشکارسازهای زیر میلیمتر هستند.
با بلندتر شدن طول آشکارساز مشکل دیگری به نام خطای پارالاکس به وجود میآید. در این حالت مکان ورود اشعه گاما به کریستال با نقطه جذب آن یکسان نیست و یک عدم قطعیت در تخمین خط پاسخ به وجود میآید. برای حل این مشکل از الگوریتمهای احتمالاتی چون MAPR استفاده میشود که با در نظر گرفتن PSF مربوط به آشکارساز، خط پاسخ صحیح را نتیجه میدهند.
عیب دیگر این روش نیاز آن به سیکلوترون در بیمارستان یا پژوهشکده است. نیمه عمر مواد تشعشعکننده پوزیترون کوتاه است و باید در محل مصرف، تولید شوند[۷].
MRI
این مدالیته روشی مرسوم برای مطالعه سیستم قلبی و عروقی در موشها بودهاست. مهمترین مزیت آن قدرت تفکیک مکان�� بسیار بالا و مناسب آن است. برای استفاده از این مدالیته در حیوانات باید نکاتی در نظر گرفته شود.
یکی از موارد مهم نیاز به میدان مغناطیسی ثابت بسیار قوی است. بر خلاف سیستمهای کلینیکی، در تصویربرداری از حیوانات از میدانهایی با قدرت ۴٫۷ تا ۱۱ تسلا استفاده میکنند. حتی در مواردی از میدان ۱۷٫۶ تسلا هم استفاده گردیده است. دلیل این موضوع رسیدن به SNR بالاتر است که بسیار اهمیت دارد و مشکل آن کم شدن کنتراست است.
نکته مهم دیگر استفاده از میدانهای گرادیان با کارایی بالاست. منظور از کارایی بالا داشتن دامنه زیاد و زمان صعود کم است. این موضوع میدان دید را کاهش میدهد اما از آنجا که ابعاد موش کوچک است، مشکلی ایجاد نخواهد کرد.
در هنگام تصویربرداری نیز باید موش را با ایزوفلورین بیهوش کرد. دمای مکان تصویربرداری نیز باید در حدود ۳۶ تا ۳۷ درجه سانتیگراد باشد. همچنین برای گرفتن تصویر در زمان مناسب، ثبت سیگنال ECG نیاز است.
با استفاده از این روش میتوان به رزولوشن مکانی ۱۰۰ تا ۲۰۰ میکرومتر برای یک اسلایس ۰٫۵ تا ۱ میلیمتر با رزولوشن زمانی ۵ تا ۱۰ میلیثانیه رسید.
PET/MRI
با تلفیق این دو مدالیته میتوان به رزولوشن بالا در کنار حساسیت بالا در ردیابی رسید. به عبارت دیگر از ویژگیهای مفید هر دو مدالیته تواماً بهرهبرداری نمود. یک ویژگی جالب که در این روش ایجاد میشود اینست که رزولوشن مکانی PET افزایش مییابد چرا که با قرار گرفتن در میدان مغناطیسی طول موج تولیدی از پوزیترونها کاهش مییابد. از طرف دیگر دادههای کمی PET با استفاده از دادههای MRI قابل بهبود هستند.
یک چالش موجود در بهرهبرداری از این روش، نحوه قرار دادن ادوات PET و MRI در کنار یکدیگر است. برای این کار میبایست ابزار PET داخل کویلهای MRI قرار گیرند. سه روش برای این کار وجود دارد. در روش اول تنها آشکارسازها درون میدان قرار دارند و با فیبرهای نوری به طول ۳ تا ۵ متر اطلاعات آنها به PMT و سایر ادوات الکترونیکی میرسد. در روش دوم تمام ادوات PET در داخل کویلهای MRI است اما این ادوات داخل یک محفظه از امواج الکترومغناطیس محافظت میشوند. در روش سوم تنها ادوات الکترونیکی شیلد میشوند و به جای PMTها از APD استفاده میشود که به میدان مغناطیسی حساس نیستند[۸].
SPECT
در این روش از همان تصویربرداری هستهای معمولی همراه با بازسازی با استفاده از نقش کردن استفاده میشود. این مدالیته توانایی مشاهده رادیو ردیابها را دارد و ویژگی دیگر جالب آن امکان تصویربرداری از گیرندهها است. همچنین این مدالیته میتواند از چند رادیو ردیاب با فوتونهایی با انرژی متفاوت به صورت همزمان تصویرسازی کند.
گرچه SPECT حساسیت کمتری از PET دارد اما از روشهایی است که حساسیت مناسبی را ارائه میدهد. با این حال این مزیت را دارد که از عناصری با نیمه عمر بیشتر استفاده میکند که میتوان آنها را در جای دیگر تولید کرد و سپس به محل مصرف منتقل نمود.
این روش از رزولوشن مکانی مناسبی برخوردار نیست. برای دستیابی به رزولوشن بهتر از فوتون با انرژی پایینتر و میزانگر تک سوراخی استفاده میشود. این میزانگر به جای میزانگرهای موازی که در کاربردهای کلینیکی رایج هستند استفاده میشود. با نزدیک شدن شی به میزانگر، بهره بالا رفته و رزولوشن زیاد میشود. البته میدان دید کاهش مییابد که برای حیوانات با ابعاد کوچک مناسب است. در این نوع میزانگر به دلیل بزرگی آن، به جای میزانگر، حیوان را میچرخاندند.
برای اینکه نیاز به چرخاندن حیوان نباشد، امروزه از میزانگر چند سوراخی بیشتر استفاده میشود. در این حالت بر روی یک آشکارساز چند تصویر از شی حاصل میشود. برای اینکه چند تصویر بدست آمده با هم همپوشانی نداشته باشند باید بهره میزانگر را کاهش داد. در این حالت ممکن است به دلیل عدم تنظیم درست قدری محو شدگی در تصویر وجود داشته باشد[۹].
CT
اساس این روش بر پایه اندازهگیری تضعیف رخ داده برای اشعه X در عبور از جسم است. این مدالیته از رزولوشن مکانی بالایی برخوردار است و میتواند تصاویر سه بعدی با دقت ۵۰ تا ۱۰۰ میکرومتر مکعب را بدست دهد. بیشترین استفاده از CT در بدست آوردن اطلاعات آناتومیکی دقیق است. توسط این اطلاعات میتوان تضعیف رخ داده در PET و SPECT را تصحیح کرد.
برای رسیدن به دقت بالاتر باید مقدار اشعه X را بالا برد تا بتوان به تصویری با وکسلهای کوچکتر دست یافت. در این حالت در کاربردهای کلینیکی امکان استفاده طولانی مدت وجود ندارد اما این مشکل در تصویربرداری از حیوانات کمتر است. امروزه تلاش میشود تا با ساخت nanoCT به دستگاهی با دقت ۱ میکرومتر دست یافت.
یکی از مشکلاتی که CT دارد این است که موادی با ویژگیهای بسیار متمایز وجود دارند که تقریباً به یک مقدار اشعه X را تضعیف میکنند. در این حالت تصویر بدست آمده از کنتراست مطلوب برخوردار نخواهد بود. یک راه حل استفاده از دستگاههای با دو سطح انرژی است که بتوان با قرار دادن سوژه در معرض هر دو سطح انرژی و پردازش تصاویر بدست آمده، کنتراست مطلوب را ایجاد کرد. به عبارت دیگر دو بافت کنار هم ممکن است در یک سطح انرژی، مقادیر تضعیف مشابهی ایجاد کنند اما در سطحی دیگر این گونه نباشد و از این موضوع میتوان برای ایجاد کنتراست بهره برد.
در حال حاضر به نظر میرسد رزولوشن مکانی و کنتراست بدست آمده از میکروسیتیها به بالاترین حد ممکن رسیدهاست اما سرعت تصویربرداری همچنان قابل بهبود است.
روش دیگری که جدیدتر میباشد، ساخت میکروسیتی بر پایهای غیر از تضعیف است. در این CTها از انکسار اشعه X استفاده میشود. در این حالت دیگر نیاز به تشعشع زیاد نیست و امکان دستیابی به تصاویری با کنتراست بالا برای بافتهای نرم و سطوح مولکولی وجود دارد.
منابع
- ↑ تعریف متعلق به آقایان دکتر Thakur (رئیس سازمان RSNA) و دکتر Lentle (ریاست جامعه پزشکی هستهای آمریکا) است و در منبع زیر قید شدهاست: Journal of Nuclear Medicine 2005: 46:11N-13N
- ↑ Robert A. de Kemp, Frederick H. Epstein, Ciprian Catana, Benjamin M.W. Tsui, and Erik L. Ritman, “Small-Animal Molecular Imaging Methods”, The Journal of Nuclear Medicine, 2010.
- ↑ http://en.wikipedia.org/w/index.php?title=George_de_Hevesy&oldid=474703249
- ↑ «PET Center - Hamamatsu Photonics | Business Domain». بایگانیشده از اصلی در ۱۶ مه ۲۰۰۸. دریافتشده در ۵ فوریه ۲۰۱۲.
- ↑ «Welcome to Concorde Microsystems!». بایگانیشده از اصلی در ۱۸ سپتامبر ۲۰۱۷. دریافتشده در ۱۶ اکتبر ۲۰۱۹.
- ↑ Multimodality Imaging
- ↑ Park J. M. , Gambhir S. S. , “Multimodality Radionuclide, Fluorescence, and Bioluminescence Small-Animal Imaging”, Proceedings of the IEEE, 2005.
- ↑ Woody C. , Schlyer D. , Vaska P. , et al. “Preliminary studies of a simultaneous PET/ MRI scanner based on the RatCAP small animal tomograph”, Nuclear Instrumentation Methods, 2007.
- ↑ S. D. Metzler, R. J. Jaszczak, “Molecular Imaging of Small Animals with a Triple-Head SPECT System Using Pinhole Collimation”, IEEE Transactions on Medical Imaging, 2005.
