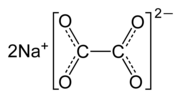
Natriumoxalat
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Natriumoxalat | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | Na2C2O4 | |||||||||||||||
| Kurzbeschreibung |
farblose und geruchlose Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 134,01 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
2,27 g·cm−3[2] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Natriumoxalat ist ein Natriumsalz der Oxalsäure mit der Summenformel Na2C2O4. Es gehört zur Gruppe der Oxalate.
Herstellung und Vorkommen
[Bearbeiten | Quelltext bearbeiten]Natriumoxalat kann durch die Umsetzung von Oxalsäure mit Natronlauge gewonnen werden.
Großtechnisch wird es aus Natriumformiat bei einer Temperatur von 360 °C hergestellt.
Außerdem fällt es in großen Mengen als Abfallstoff beim Bayer-Verfahren (Herstellung von Aluminiumhydroxid „Tonerdehydrat“) an.[3]
In der Natur kommt Natriumoxalat als das sehr seltene Mineral Natroxalat vor.
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Natriumoxalat ist ein farbloses als Pulver gut rieselfähiges Salz, das nicht hygroskopisch wirkt und sich nur mäßig in Wasser löst. Es kristallisiert im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3).[4]
Bei 290 °C beginnt die Zersetzung von Natriumoxalat in Natriumcarbonat und Kohlenmonoxid.[5]
Die Lösungsenthalpie von Natriumoxalat bei 298,15 K beträgt 13,86 kJ·mol−1.[6]
Verwendung
[Bearbeiten | Quelltext bearbeiten]Es kann in Verbindung mit Mangan(II)-sulfid zur Einstellung von Kaliumpermanganat-Maßlösungen (Urtitersubstanz nach Sørensen) eingesetzt werden (siehe auch Manganometrie). Bei der Galvanisierung findet eine Lösung namens Natrium-Eisen(III)-oxalat Anwendung, die unter anderem aus Natriumoxalat gewonnen wird. Des Weiteren kann es als Farbgeber (gelb/orange) in der Pyrotechnik verwendet werden. In der Metallurgie findet es Verwendung z. B. bei der Röstung von Vanadiumerzen im Drehofen (Umsetzung von Vanadium(V)-oxid zu Natriummetavanadat). Weitere Anwendungen findet es als Hilfsmittel in der Textilindustrie und als Inhaltsstoff bei Spezialzementen.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu SODIUM OXALATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 1. November 2021.
- ↑ a b c d e f Eintrag zu Natriumoxalat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- ↑ a b Eintrag zu Natriumoxalat. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. September 2014.
- ↑ J. Lowe, M. Ogden, A. McKinnon, G. Parkinson: Crystal growth of sodium oxalate from aqueous solution. In: Journal of Crystal Growth 2002, 237-239, S. 408–413. doi:10.1016/S0022-0248(01)01864-4.
- ↑ T. Yoshimori, Y. Asano, Y. Toriumi and T. Shiota: Investigation on the drying and decomposition of sodium oxalat. In: Talanta 1978, 25(10), S. 603–605. doi:10.1016/0039-9140(78)80158-1.
- ↑ M. Z. H. Rozaini, P. Brimblecombe: The solubility measurements of sodium dicarboxylate salts; sodium oxalate, malonate, succinate, glutarate, and adipate in water from T = (279.15 to 358.15) K. In: The Journal of Chemical Thermodynamics 2009, 41(9), S. 980–983. doi:10.1016/j.jct.2009.03.017.



