o-Toluidin
| o-toluidin | |
|---|---|
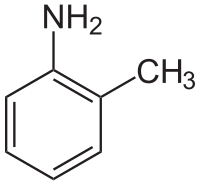 Strukturní vzorec | |
| Obecné | |
| Systematický název | 2-methylanilin |
| Ostatní názvy | 2-methylbenzen-1-amin, 1-amino-2-methylbenzen, o-toluidin |
| Sumární vzorec | C7H9N |
| Vzhled | bezbarvá až nažloutlá kapalina[1] |
| Identifikace | |
| Registrační číslo CAS | 95-53-4 |
| EC-no (EINECS/ELINCS/NLP) | 202-429-0 |
| PubChem | 7242 |
| SMILES | CC1=CC=CC=C1N[1] |
| InChI | InChI=1/C7H9N/c1-6-4-2-3-5-7(6)8/h2-5H,8H2,1H3 |
| Číslo RTECS | XU2975000 |
| Vlastnosti | |
| Molární hmotnost | 107,20 g/mol |
| Teplota tání | −16,3 °C (256,8 K)[1] |
| Teplota varu | 200,3 °C (473,4 K)[1] |
| Hustota | 0,998 g/cm3 (20 °C)[1] |
| Viskozita | 3,823 mPas[1] |
| Disociační konstanta pKa | 4,44 (konjugovaná kyselina)[1] |
| Rozpustnost ve vodě | 1,66 g/100 ml[1] |
| Rozpustnost v polárních rozpouštědlech | rozpustný v ethanolu[1] |
| Rozpustnost v nepolárních rozpouštědlech | rozpustný v diethyletheru a tetrachlormethanu[1] |
| Tlak páry | 34,5 kPa[1] |
| Termodynamické vlastnosti | |
| Standardní slučovací entalpie ΔHf° | −6,3 kJ/mol[1] |
| Standardní molární spalná entalpie ΔH°sp | −40,3 MJ/mol[1] |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H301 H319 H331 H350 H400[1] |
| P-věty | P201 P202 P261 P264 P270 P271 P273 P280 P281 P301+310 P304+340 P305+351+338 P308+313 P311 P321 P330 P337+313 P391 P403+233 P405 P501[1] |
| Teplota vzplanutí | 85 °C (358 K)[1] |
| Teplota vznícení | 482 °C (755 K)[1] |
Některá data mohou pocházet z datové položky. | |
o-Toluidin (systematický název 2-methylanilin) je organická sloučenina, aminovaný derivát toluenu. Jedná se o nejvýznamnější látku ze skupiny toluidinů, monoaromatických uhlovodíků, které mají na benzenové jádro navázanou jednu aminovou a jednu methylovou skupinu. V čisté podobě se jedná o bezbarvou kapalinu, běžně prodávané vzorky jsou často nažloutlé. Používá se na výrobu herbicidů metolachloru a acetochloru.[2]
Výroba a reakce
[editovat | editovat zdroj]o-Toluidin se vyrábí nitrací toluenu, při které vniká směs nitrotoluenů, přičemž mezi produkty převažuje o-izomer. Z této směsi se destilací oddělí 2-nitrotoluen, který je následně hydrogenován na o-toluidin.[2]
Přeměnu o-toluidinu na diazoniovou sůl lze použít k získání 2-brom, 2-kyano- a 2-chlortoluenu.[3][4][5] Byla také popsána N-acetylace.[6]
Metabolismus
[editovat | editovat zdroj]Absorpce, distribuce a vylučování
[editovat | editovat zdroj]o-Toluidin se do těla může dostat vdechnutím nebo přes kůži. Byla pozorována absorpce této látky trávicí soustavou.[7][7][8][9][10] Většina o-toluidinu se vylučuje močí, přičemž z toho až třetina v nezměněné podobě. Hlavním metabolitem je 4-amino-m-krezol a v menším množství se tvoří také N-acetyl-4-amino-m-krezol,[9] azoxytoluen, o-nitrosotoluen, N-acetyl-o-toluidin, N-acetyl-o-aminobenzylalkohol, kyselina anthranilová, kyselina N-acetyl-anthranilová, 2-amino-m-krezol a p-hydroxy-o-toluidin. Nejčastější konjugáty jsou ty se síranovými ionty, jež se vytvářejí v přibližně šestkrát větším množství než glukuronidové. Metabolismus o-toluidinu se skládá z řady aktivačních i deaktivačních procesů, jako jsou N-acetylace, N-oxidace a N-hydroxylace, oxidace cyklu.[11] U krys jsou nejvýznamnějšími způsoby metabolizace 4-hydroxylace a N-acetylace. Primární metabolismus o-toluidinu probíhá v endoplazmatickém retikulu. Vystavení organismu o-toluidinu vede ke zvýšení mikrozomální aktivitu arylhydroxylázy, NADPH—cytochrom-c2 reduktázy a množství cytochromu P-450. BV játrech probíhá cytochromem P450 řízená N-hydroxylace na N-hydroxy-o-toluidin, který je karcinogenní. N-Hydroxy-o-toluidin může být metabolizován na o-nitrosotoluen i konjugován s kyselinou glukuronovou i sírany krví se dostat do močového měchýře. kde dochází k uvolnění N-hydroxy-o-toluidinu v kyselém prostředí a ten může přímo reagovat s DNA nebo být aktivován sulfatací či acetylací cytozolovými sulfotransferázami nebo N-acetyltransferázami (hlavně NAT1).[12] Předpokládaná aktivní forma, N-acetoxy-o-toluidin, je reaktivní ester. který vytváří elektrofilní arylnitreniové ionty, jež se mohou vázat DNA.[11][13][14] Dalšími způsoby aktivace jsou peroxidační reakce vedoucí ke vzniku reaktivních metabolitů (chinoniminů vznikajících z nekonjugovaných fenolových metabolitů). Tyto metabolity mohou vytvářet reaktivní formy kyslíku, což vede k oxidativnímu poškození buněk.[15][16] Tento mechanismus podporují pozorování o-toluidinem způsobených poškození DNA u uměle pěstovaných buněk lidského močového měchýře a buněk krys a myší vystavených in vivo o-toluidinu.[17][18]

Vazba na hemoglobin
[editovat | editovat zdroj]Metabolity o-toluidinu se u krys vážou na hemoglobin;[19] příslušným metabolitem je pravděpodobně o-nitrosotoluen,[14][20] který je pro krysy karcinogenní.[21] Nitrosotoluen přeměňuje hemoglobin na methemoglobin, čímž způsobuje methemoglobinémii.[22][23] Byly nalezeny důkazy o tom, že podobně je o-toluidin metabolizován i u člověka.[11]
Karcinogenita
[editovat | editovat zdroj]I když mechanismus karcinogenity o-toluidinu není zcela popsán, tak z dostupných dat vyplývá, že je složitý a skládá se z několika dílčích procesů, jako je metabolická aktivace vedoucí k vazbě reaktivních metabolitů na DNA a bílkoviny, mutagenita, oxidativní poškozování DNA a cytotoxicita.[15][16]
Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku o-Toluidine na anglické Wikipedii.
- ↑ a b c d e f g h i j k l m n o p q r s o-Toluidine. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-24]. Dostupné online. (anglicky)
- ↑ a b Ullmann's Encyclopedia of Industrial Chemistry. Příprava vydání Wiley-VCH. 1. vyd. [s.l.]: Wiley Dostupné online. ISBN 978-3-527-30385-4, ISBN 978-3-527-30673-2. DOI 10.1002/14356007.a27_159. (anglicky) DOI: 10.1002/14356007.
- ↑ H. T. Clarke; R. R. Read. o-Tolunitrile and p-Tolunitrile. Organic Syntheses. 1925, s. 69. DOI 10.15227/orgsyn.004.0069.
- ↑ L. A. Bigelow. o-Bromotoluene. Organic Syntheses. 1929, s. 22. DOI 10.15227/orgsyn.009.0022.
- ↑ C. S. Marvel; S. M. McElvain. o-Chlorotoluene and p-Chlorotoluene. Organic Syntheses. 1923, s. 33. DOI 10.15227/orgsyn.003.0033.
- ↑ Rolf Huisgen; Klaus Bast. Indazole. Organic Syntheses. 1962, s. 69. DOI 10.15227/orgsyn.042.0069.
- ↑ a b K. Cheever; D. Richards; H. Plotnick. Metabolism of o-, m- and p-toluidine in the adult male rat. Toxicol. Appl. Pharm.. 1980, s. 361–369. DOI 10.1016/0041-008x(80)90069-1. PMID 7222020.
- ↑ R. C. Hiles; K. M. Abdo. Nitrogen and Phosphorus Solvents. Příprava vydání D. R. Buhler, D. J. Reed. [s.l.]: Elsevier, 1990. Kapitola 5. ortho-Toluidine, s. 202–207.
- ↑ a b O. S. Son; D. W. Everett; E. S. Fiala. Metabolism of o-[methyl-14C]toluidine in the F344 rat. Xenobiotica. 1980, s. 457–468. DOI 10.3109/00498258009033781. PMID 7445517.
- ↑ W. J. Brock; S. G. Hundley; P. H. Lieder. Hepatic macromolecular binding and tissue distribution of ortho- and para-toluidine in rats. Toxicology Letters. 1990, s. 317–325. DOI 10.1016/0378-4274(90)90199-v. PMID 1701932.
- ↑ a b c K. Riedel; G. Scherer; J. Engl; H. W. Hagedorn; A. R. Tricker. Determination of three carcinogenic aromatic amines in urine of smokers and nonsmokers. Journal of Analytical Toxicology. 2006, s. 187–195. DOI 10.1093/jat/30.3.187. PMID 16803653.
- ↑ 'o-Toluidine [online]. US National Institute of Health. Dostupné online.
- ↑ F. F. Kadlubar; A. F. Badawi. Genetic susceptibility and carcinogen-DNA adduct formation in human urinary bladder carcinogenesis. Toxicology Letters. 1995, s. 627–632. Dostupné online. DOI 10.1016/0378-4274(95)03507-9. PMID 8597119.
- ↑ a b J. C. English; V. S. Bhat; G. L. Ball; C. J. McLellan. Establishing a total allowable concentration of o-toluidine in drinking water incorporating early lifestage exposure and susceptibility. Regulatory Toxicology and Pharmacology. 2012, s. 269–284. Dostupné online. DOI 10.1016/j.yrtph.2012.08.011. PMID 22940434.
- ↑ a b Y. Y. Ohkuma; S. Hiraku; S. Oikawa; N. Yamashita; M. Murata; S. Kawanishi. Distinct mechanisms of oxidative DNA damage by two metabolites of carcinogenic o-toluidine. Archives of Biochemistry and Biophysics. 1999, s. 97–106. DOI 10.1006/abbi.1999.1461. PMID 10562421.
- ↑ a b C. Watanabe; T. Egami; K. Midorikawa; Y. Hiraku; S. Oikawa; S. Kawanishi; M. Murata. DNA damage and estrogenic activity induced by the environmental pollutant 2-nitrotoluene and its metabolite. Environmental Health and Preventive Medicine. 2010, s. 319–326. DOI 10.1007/s12199-010-0146-1. PMID 21432561.
- ↑ L. Robbiano; R. Carrozzino; M. Bacigalupo; C. Corbu; G. Brambilla. Correlation between induction of DNA fragmentation in urinary bladder cells from rats and humans and tissue-specific carcinogenic activity. Toxicology. 2002, s. 115–128. DOI 10.1016/s0300-483x(02)00354-2. PMID 12204548.
- ↑ K. Sekihashi; A. Yamamoto; Y. Matsumura; S. Ueno; M. Watanabe-Akanuma; F. Kassie; S. Knasmuller. Comparative investigation of multiple organs of mice and rats in the comet assay. Mutation Research. 2002, s. 53–75. DOI 10.1016/s1383-5718(02)00034-7. PMID 12034309.
- ↑ G. Birnier; H. Neumann. Biomonitoring of aromatic amines. II: Haemoglobin binding of some monocyclic aromatic amines. Archives of Toxicology. 1988, s. 110–115. DOI 10.1007/BF00570128. PMID 3196145.
- ↑ P. Eyer. The red cell as a sensitive target for activated toxic arylamines. Arch. Toxicol. Suppl.. 1983, s. 3–12. ISBN 978-3-540-12392-7. DOI 10.1007/978-3-642-69083-9_1. PMID 6578736.
- ↑ S. S. Hecht; K. El-Bayoumy; A. Rivenson; E. Fiala. Bioassay for carcinogenicity of 1,2-dimethyl-4-nitrosobiphenyl, o-nitrosotoluene, nitrosobenzene and the corresponding amines in Syrian golden hamsters. Cancer Letters. 1983, s. 349–354. DOI 10.1016/0304-3835(83)90034-4. PMID 6627231.
- ↑ Hazardous Substances Data Bank (HSDB, online database). [s.l.]: U.S. Department of Health and Human Services, 1997.
- ↑ Patty's Industrial Hygiene and Toxicology. Příprava vydání G. D. Clayton, F. E. Clayton. [s.l.]: John Wiley & Sons, 1981. Dostupné online.
Externí odkazy
[editovat | editovat zdroj] Obrázky, zvuky či videa k tématu o-toluidin na Wikimedia Commons
Obrázky, zvuky či videa k tématu o-toluidin na Wikimedia Commons




