Elektrosyntéza
Elektrosyntéza je označení pro metody syntézy chemických sloučenin pomocí elektrochemických článků.[1][2][3][4]
Ve srovnání s běžnými redoxními reakcemi se v elektrosyntézách může někdy dosahovat vyšších selektivit a výtěžků. Elektrosyntézy jsou často zkoumány a mají i průmyslová využití. Elektrooxidace mohou být například použity při zpracování odpadních vod.
Provedení
[editovat | editovat zdroj]Základními zařízeními používanými při elektrosyntézách jsou galvanický článek, potenciostat a dvojice elektrod. Rozpouštědlo a elektrolyt se vybírají tak, aby elektrický odpor byl co nejmenší.[5]
K získání protického prostředí často slouží směsi vody s alkoholy nebo dioxanem; jako elektrolyty se používají rozpustné soli, kyseliny nebo zásady. Aprotické podmínky se obvykle navozují organickými rozpouštědly, například acetonitrilem nebo dichlormethanem, a elektrolyty jako jsou chloristan lithný či tetrabutylamonné soli. Velký vliv může mít složení a plocha povrchu elektrod,[6] ve vodném prostředí se jako produkty vedlejších reakcí vytváří na anodě kyslík a na katodě vodík. K zabránění těmto reakcím lze použít grafitovou anodu s olověnou katodou. Používají se i jiné materiály pro elektrody, například platina, hořčík, rtuť nebo nerezová ocel. Při některých reakcích se elektrody spotřebovávají, v takovém případě může být materiálem například zinek nebo olovo. Články mohou být nerozdělené nebo rozdělené. U rozdělených jsou katoda a anoda odděleny polopropustnou membránou, vyrobenou například ze spékaného skla, porézního porcelánu, polytetrafluorethylenu nebo polypropylenu. Rozdělené články umožňují difúzi iontů a současně omezují tok produktů a reaktantů. Jako příklad reakce s využitím rozdělených článků lze uvést redukci nitrobenzenu na fenylhydroxylamin, kde by druhá z uvedených látek mohla oxidovat anodu.
Reakce
[editovat | editovat zdroj]Na anodách probíhají oxidace, na katodách redukce. Úvodní reakce proběhne na povrchu elektrody a následně meziprodukty difundují roztokem a účastní se sekundárních reakcí. Meziprodukty často bývají radikály.
Účinnosti elektrosyntetických reakcí lze vyjádřit pomocí výtěžnosti i účinnosti proudu. Účinnost proudu se určuje jako poměr elektrického náboje spotřebovaného na vznik produktů a náboje, který prošel článkem. Vedlejší reakce účinnost proudu snižují.
Rychlost reakce je určována rozdílem potenciálů mezi elektrodami. Elektrosyntézy probíhají za stálého potenciálu nebo stálého proudu; výběr jedné z těchto možností závisí na vyvážení snadnosti provedení a účinnosti proudu. Stálý potenciál je účinnější než stálý proud a článek se v průběhu reakce zmenšuje vlivem spotřebovávání substrátu okolo elektrody (ke zmenšení difúzní vrstvy kolem elektrody je zpravidla potřeba reakční směs promíchávat). Za stálého proudu dochází se snižováním koncentrace substrátu ke snížení potenciálu na článku, čímž se udržuje stálá rychlost reakce; část proudu se přitom spotřebovává na vedlejší reakce.
Oxidace na anodách
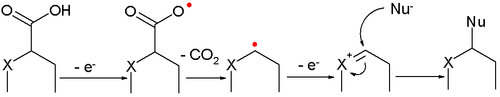
[editovat | editovat zdroj]- Často používaným příkladem je Kolbeova elektrolýza, kdy dochází k dekarboxylaci dvou karboxylových kyselin a spojení zbývajících struktur:
- Obměnami jsou nekolbeovské reakce, kdy je navázán heteroatom (dusík nebo kyslík) do polohy α. Oxoniový meziprodukt je zachycen nukleofilem, jímž většinou bývá rozpouštědlo.
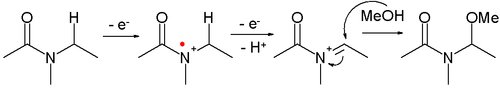
- Amidy karboxylových kyselin je možné oxidovat na N-acyliminiové ionty, zachytitelné mnoha různými nukleofily:
Tento druh reakce se označuje jako Shonova oxidace. Jako příklad může sloužit α-methoxylace N-karbomethoxypyrrolidinu.[8]
- Oxidací karboaniontů může docházet k párovacím reakcím, jako je elektrosyntéza tetramethylesteru kyseliny ethantetrakarboxylové z odpovídajícího esteru kyseliny malonové.[9]
- α-aminokyseliny vytváří nitrily a oxid uhličitý oxidačními dekarboxylacemi na anodách z oxidu stříbrno-stříbřitého, vytvořeného in-situ oxidací oxidu stříbrného):[5][10]
- Kyselinu kyanooctovou lze získat katodovou redukcí oxidu uhličitého a následnou anodovou oxidací acetonitrilu.[11]
- Kyselina propiolová se vyrábí oxidací propargylalkoholu na olověné elektrodě.[12]
Redukce na katodách
[editovat | editovat zdroj]- Při Markóových–Lamových deoxygenacích lze deoxygenovat alkoholy elektroredukcemi jejich toluátových esterů.
- Adiponitril se teoreticky získává dimerizací akrylonitrilu,[13]
- 2 CH2=CHCN + 2 e− + 2 H+ → NCCH2CH2CH2CH2CN
průmyslová výroba spočívá v hydrodimerizaci aktivovaného alkenu získaného z akrylonitrilu:
- Katodová redukce arenů na 1,4-dihydrosloučeniny je podobná Birchově redukci. Průmyslově se využívá při redukci kyseliny ftalové:
a 2-methoxynaftalenu:
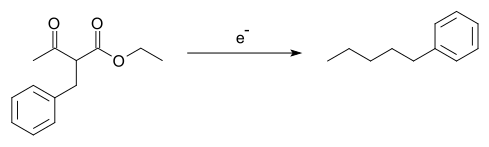
- Tafelův přesmyk byl využíván na výrobu některých uhlovodíků z alkylovaných derivátů ethylacetacetátu, dochází při něm k přesmyku alkylové skupiny:[14][15]
- Katodovými redukcemi nitrilů v rozdělených článcích vznikají primární aminy; níže je zobrazena redukce benzylkyanidu na fenylethylamin.[16]
- Katodovou redukcí nitroalkenů se, s dobrou výtěžností, vytváří oximy. Při větších záporných redukčních potenciálech lze nitroalkeny dále redukovat na primární aminy, výtěžnosti jsou ovšem nižší.[17]
- Azobenzen se také vyrábí elektrosynteticky; výchozí látkou je zde nitrobenzen.[13]
- Elektrochemická karboxylace para-isobutylbenzylchloridu na ibuprofen se provádí v superkritickém oxidu uhličitém.[18]
- Katodovými redukcemi karboxylových kyselin v rozdělených článcích se vytvářejí aldehydy, například kyselina šťavelová se mění na kyselinu glyoxalovou:[19][20]
- Kyselina fenylpropanová se vyráběla redukcí kyseliny skořicové.[21]
- Elektrokatalytickou reakcí katalyzovanou mědí se redukuje oxid uhličitý na kyselinu šťavelovou.[22]
- Byla popsána tvorba kyseliny mravenčí elektrochemickou redukcí oxidu uhličitého (dodávaného hydrogenuhličitanem) na olověné katodě při pH 8,6:[23]
- HCO -
3 + H2O + 2 e− → HCO -
2 + 2 OH−
nebo
- CO2 + H2O + 2 e− → HCO -
2 + OH−
Když je surovinou oxid uhličitý a na anodě se vyvíjí kyslík, celková rovnice reakce je:
- 2 CO2 + 2 OH− → 2 HCO -
2 + O2
Redoxní reakce
[editovat | editovat zdroj]- Katodová redukce oxidu uhličitého a anodová oxidace acetonitrilu za vzniku kyseliny kyanoctové[11]
- Elektrosyntézou využívající střídavý proud lze získávat fenol současně na katodě i anodě.[24]
Elektrofluorace
[editovat | editovat zdroj]Řada perfluorovaných sloučenin se vyrábí elektrochemicky, v kapalném fluorovodíku při napětí 5–6 V pomocí niklových anod. Tento postup byl vyvinut ve 30. letech 20. století.[25]
Tímto způsobem lze na perfluorované produkty přeměnit aminy, alkoholy, karboxylové a sulfonové kyseliny. Roztok nebo suspenze uhlovodíku ve fluorovodíku se elektrolyzuje při 5 až 6 V, kdy se dosahuje nejlepších výtěžností.
Odkazy
[editovat | editovat zdroj]Související články
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]V tomto článku byl použit překlad textu z článku Electrosynthesis na anglické Wikipedii.
- ↑ Jeffrey B. Sperry; Dennis L. Wright. The application of cathodic reductions and anodic oxidations in the synthesis of complex molecules. Chemical Society Reviews. 2006, s. 605–621. DOI 10.1039/b512308a. PMID 16791332.
- ↑ Topics in current chemistry. Electrochemistry, Vol. 3 (Topics in Current Chemistry, Vol. 148) E. Steckhan (Ed), Springer, NY 1988
- ↑ M. Yan; Y. Kawamata; P. S. Baran. Synthetic Organic Electrochemistry: Calling All Engineers. Angewandte Chemie International Edition. 2017, s. 4149–4155. DOI 10.1002/anie.201707584. PMID 28834012.
- ↑ James Utley. Trends in Organic Electrosynthesis. Chemical Society Reviews. 1997, s. 157. DOI 10.1039/cs9972600157.
- ↑ a b James Grimshaw. Electrochemical Reactions and Mechanisms in Organic Chemistry. Amsterdam: Elsevier Science, 2000. Dostupné online. ISBN 9780444720078. S. 1–7, 282, 310.
- ↑ D. M. Heard; A. J. J. Lennox. Electrode Materials in Modern Organic Electrochemistry. Angewandte Chemie International Edition. 2020-07-06, s. 18866–18884. DOI 10.1002/anie.202005745. PMID 32633073.
- ↑ H. J. Schäfer; U. Feldhues. Oxidation of Primary Aliphatic Amines to Nitriles at the Nickel Hydroxide Electrode. Synthesis. 1982, s. 145–146. DOI 10.1055/s-1982-29721.
- ↑ Organic Syntheses, Coll. Vol. 7, p.307 (1990); Vol. 63, p.206 (1985) [online]. Dostupné v archivu pořízeném z originálu dne 2007-09-26.
- ↑ Organic Syntheses, Coll. Vol. 7, p.482 (1990); Vol. 60, p.78 (1981) [online]. Dostupné v archivu pořízeném z originálu dne 2007-09-26.
- ↑ N. Hampson; J. Lee; K. MacDonald. The oxidation of amino compounds at anodic silver. Electrochimica Acta. 1972, s. 921–955. DOI 10.1016/0013-4686(72)90014-X.
- ↑ a b Fructuoso Barba; Belen Batanero. Paired Electrosynthesis of Cyanoacetic Acid. The Journal of Organic Chemistry. 2004, s. 2423–2426. DOI 10.1021/jo0358473. PMID 15049640.
- ↑ Wilhelm Riemenschneider. Ullmann's Encyclopedia of Industrial Chemistry. Weinheim: Wiley-VCH, 2002. ISBN 3527306730. DOI 10.1002/14356007.a05_235. Kapitola Carboxylic Acids, Aliphatic.
- ↑ a b D. S. Cardoso; B. Šljukić; D. M. Santos; S. A. Sequeira. Organic Electrosynthesis: From Laboratorial Practice to Industrial Applications. Organic Process Research & Development. 2017-07-17, s. 1213–1226. DOI 10.1021/acs.oprd.7b00004.
- ↑ Electrochemistry Encyclopedia – Tafel: his life and science [online]. Dostupné v archivu pořízeném z originálu dne 2012-02-06.
- ↑ Julius Tafel; Hans Hahl. Vollständige Reduktion des Benzylacetessigesters. Berichte der deutschen chemischen Gesellschaft. 1907, s. 3312–3318. Dostupné online. DOI 10.1002/cber.190704003102.
- ↑ V. Krishnan; A. Muthukumaran; H. V. K. Udupa. The electroreduction of benzyl cyanide on iron and cobalt cathodes. Journal of Applied Electrochemistry. 1979, s. 657–659. DOI 10.1007/BF00610957.
- ↑ M. Wessling; H. J. Schäfer. Cathodic reduction of 1-nitroalkenes to oximes and primary amines. Chemische Berischte. 1991, s. 2303–2306. DOI 10.1002/cber.19911241024.
- ↑ Toshiyasu Sakakura; Jun-Chul Choi; Hiroyuki Yasuda. Transformation of Carbon dioxide. Chemical Reviews. 2007-06-13, s. 2365–2387. DOI 10.1021/cr068357u. PMID 17564481.
- ↑ Julius Tafel; Gustav Friedrichs. Elektrolytische Reduction von Carbonsäuren und Carbonsäureestern in schwefelsaurer Lösung. Berichte der Deutschen Chemischen Gesellschaft. 1904, s. 3187–3191. Dostupné online. DOI 10.1002/cber.190403703116.
- ↑ Julius Cohen. Practical Organic Chemistry. London: Macmillan and Co., 1920. Dostupné online. S. 102–104.
- ↑ A. W. INGERSOLL. Hydrocinnamic acid. Org. Synth.. 1929, s. 42. Dostupné online.; Coll. Vol.. S. 311.
- ↑ Elisabeth Bouwman; Raja Angamuthu; Philip Byers; Martin Lutz; Anthony L. Spek. Electrocatalytic CO2 Conversion to Oxalate by a Copper Complex. Science. 2010-07-15, s. 313–315. Dostupné online. DOI 10.1126/science.1177981. PMID 20075248. Bibcode 2010Sci...327..313A.
- ↑ B. Innocent. Electro-reduction of carbon dioxide to formate on lead electrode in aqueous medium. Journal of Applied Electrochemistry. 2009, s. 227–232. DOI 10.1126/science.1177981. PMID 10.1007/s10800-008-9658-4.
- ↑ Byungik Lee; Hiroto Naito; Masahiro Nagao; Takashi Hibino. Alternating-Current Electrolysis for the Production of Phenol from Benzene. Angewandte Chemie International Edition. 2012-07-09, s. 6961–6965. DOI 10.1002/anie.201202159. PMID 22684819.
- ↑ J. H. Simons. Production of Fluorocarbons I. The Generalized Procedure and its Use with Nitrogen Compounds. Journal of the Electrochemical Society. 1949, s. 47–52. DOI 10.1149/1.2776733.