Fosfol
| Fosfol | |
|---|---|
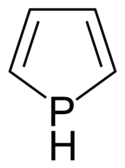 Strukturní vzorec | |
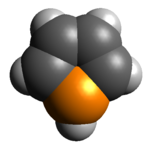 Model molekuly | |
| Obecné | |
| Systematický název | 1H-fosfol |
| Sumární vzorec | C4H5P |
| Identifikace | |
| Registrační číslo CAS | 288-01-7 |
| PubChem | 164575 |
| SMILES | P1C=CC=C1 |
| InChI | InChI=1S/C4H5P/c1-2-4-5-3-1/h1-5H |
| Vlastnosti | |
| Molární hmotnost | 84,056 g/mol |
Některá data mohou pocházet z datové položky. | |
Fosfol je organická sloučenina se vzorcem C4H4PH, fosforový analog pyrrolu. Deriváty tohoto heterocyklu se také označují jako fosfoly; jsou předměty teoretického výzkumu, ale slouží i jako ligandy v komplexech přechodných kovů a na přípravu složitějších organofosforových sloučenin.
Jsou také známy obdobné heterocykly obsahující více atomů fosforu, trifosfol, C2H3P3, obsahuje 3 fosfory a pentafosfol, P5H, jich má v molekule 5.
Struktura
Na rozdíl od obdobných pětičlenných heterocyklických sloučenin pyrrolu, thiofenu a furanu je aromaticita fosfolu omezená, protože u něj nedochází k delokalizaci volného elektronového páru.[1] Tento jev se projevuje pyramidalizací molekuly, kdy je její rovinný tvar vychýlen směrem k tetraedrickému. Nearomatičnost také ovlivňuje reaktivitu fosfolů.[2]
Fosfoly vstupují do jiných cykloadičních reakcí a mají také odlišné koordinační vlastnosti.[3]
Příprava
Základní molekula fosfolu byla poprvé připravena v roce 1983, a to protonací fosfolidu lithného za nízké teploty.[4] Pentafenylfosfol byl popsán již roku 1953.[5]
Fosfoly lze připravit například McCormackovou reakcí, spočívající v adici 1,3-dienu na chlorid fosforitý, za vzniku RPCl2, a následnou dehydrohalogenací.[6] Fenylfosfoly mohou být vytvořeny reakcemi zirkonacyklopentadienů s dichlorfenylfosfinem (PhPCl2).[7]
Reakce
Vlastnosti sekundárních fosfolů, tedy těch, které obsahují vazbu P-H, určují hlavně navázané skupiny.[4] Samotný fosfol se snadno přeměňuje přesunem H z P na uhlík v poloze 2 a následnou dimerizací.
Většina připravovaných fosfolů patří mezi terciární, na atom fosforu se nejčastěji navazují methylové a fenylové skupiny. Nearomaticita těchto fosfolů má vliv na jejich reaktivitu (která se ovšem netýká vazby P-C). Mohou se například účastnit Dielsových–Alderových reakcí s elektrofilními alkyny. Atomy fosforu jsou zde zásadité a mohou sloužit jako ligandy.[4]
2,5-difenylfosfoly lze funkcionalizovat deprotonací následovanou P-acylací; vytváří se přitom rovnováha mezi 1H, 2H a 3H fosfolidy vedoucí k 1:3 posunu acylu.[8]
Fosfoly je také možné přeměnit na β-funkcionalizované fosfabenzeny (fosforiny) pomocí imidoylchloridů a inserčních reakcí.[9]
Odkazy
Související články
Externí odkazy
 Obrázky, zvuky či videa k tématu Fosfol na Wikimedia Commons
Obrázky, zvuky či videa k tématu Fosfol na Wikimedia Commons
Reference
V tomto článku byl použit překlad textu z článku Phosphole na anglické Wikipedii.
- ↑ D. B. Chesnut; L. D. Quin. The important role of the phosphorus lone pair in phosphole aromaticity. Heteroatom Chemistry. 2007, s. 754. DOI 10.1002/hc.20364.
- ↑ Philip Hindenberg; Carlos Romero-Nieto. Phosphaphenalenes: An Evolution of the Phosphorus Heterocycles. Synlett. 2016, s. 2293–2300. DOI 10.1055/s-0035-1562506.
- ↑ Almaz Zagidullin; Vasily A. Miluykov. Phospholes – development and recent advances. Mendeleev Communications. 2013, s. 117–130. DOI 10.1016/j.mencom.2013.05.001.
- ↑ a b c Claude Charrier; Hubert Bonnard; Guillaume De Lauzon; Francois Mathey. Proton [1,5] shifts in P-unsubstituted 1H-phospholes. Synthesis and chemistry of 2H-phosphole dimers. Journal of the American Chemical Society. 1983, s. 6871–6877. DOI 10.1021/ja00361a022.
- ↑ A Guide to Organophosphorus Chemistry Louis D. Quin 2000 John Wiley & Sons ISBN 0-471-31824-8
- ↑ W. B. MCCORMACK. 3-Methyl-1-Phenylphospholene oxide. Org. Synth.. 1973. Dostupné online.; Coll. Vol.. S. 787.
- ↑ PAUL J. FAGAN; WILLIAM A. NUGENT. 1-Phenyl-2,3,4,5-Tetramethylphosphole. Org. Synth.. 1998. Dostupné online.; Coll. Vol.. S. 653.
- ↑ Magali Clochard; Joanna Grundy; Bruno Donnadieu; François Mathey. A straightforward synthesis of 3-acylphospholes. Organic Letters. 2005, s. 4511–4513. DOI 10.1021/ol051816d. PMID 16178571.
- ↑ J. Grundy; F. Mathey. One-Pot Conversion of Phospholide Ions into β-Functional Phosphinines. Angewandte Chemie International Edition. 2005, s. 1082–1084. DOI 10.1002/anie.200462020. PMID 15662672.