ثلاسيميا بيتا
هذه المقالة بحاجة لمراجعة خبير مختص في مجالها. (أبريل 2016) |
| ثلاسيميا بيتا | |
|---|---|
وراثيات الثلاسيميا بيتا
| |
| معلومات عامة | |
| الاختصاص | علم الدم |
| من أنواع | ثلاسيميا[1]، ومرض صماوي جيني نادر [2]، ومرض |
| تعديل مصدري - تعديل | |
بيتا ثلاسيميا هو نوع آخر من ثلاسيميا، النوع الآخر يطلق عليه الالفا ثلاسيما، وتكمن المشكلة هنا في عطب بتكوين السلسلة بيتا، التي تدخل في تكوين هيموغلوبين البالغين، مما يؤدي إلى نقص أو حتى عدم تكونها.[3][4][5] ويتصف هذا النوع باتساع انتشاره.
انتشار المرض
[عدل]ينتشر المرض بين الأمريكين من أصول أفريقية (مثل معظم الامراض الجينية التي تصيب الدم)، والايطالين، واليونان، ودول الشرق الأوسط والهند.
سبب الإصابة بالمرض
[عدل]خلل في الجين (المادة الوراثية) المسؤولة عن تكوين السلسة بيتا، مما يؤدي إلى خلل في إنتاج هذه السلسلة وزيادة في إنتاج السلسلة ألفا، والذي ينتج عنه ارتباط السلسلة ألفا بسلاسل أخرى وتكوين أنواع أخرى من خضاب الدم (اليحمور).
تقع الطفرة المسببة لمرض الثلاسيميا بيتا في جين HBB، الذي يقع في الكروموسوم 11 لدى الإنسان.[6]
يوفر جين HBB تعليمات لصنع بروتين يسمى بيتا غلوبين. بيتا غلوبين هو مكون (وحدة فرعية) من بروتين أكبر يسمى الهيموغلوبين، والذي يقع داخل خلايا الدم الحمراء.[6]
تم العثور على مئات المتغيرات (الطفرات) في جين HBB التي تسبب الثلاسيميا بيتا، تتضمن معظم الطفرات تغييراً في وحدة بناء DNA واحدة (النيوكليوتيدات) داخل جي�� HBB أو بالقرب منه. تقوم الطفرات الأخرى بإدخال أو حذف عدد صغير من النيوكليوتيدات في جين HBB.[6]
تؤدي متغيرات جين HBB التي تقلل إنتاج بيتا غلوبين إلى حالة تسمى الثلاسيميا بيتا بلس (β+)، أما المتغيرات التي تمنع الخلايا من إنتاج أي بيتا غلوبين فتؤدي إلى مرض الثلاسيميا بيتا صفر (β0).[6]
تمنع بعض المتغيرات في جين HBB إنتاج أي بيتا غلوبين. ويشار إلى غياب بيتا غلوبين باسم الثلاسيميا بيتا صفر (β0). تسمح المتغيرات الجينية الأخرى لـ HBB بإنتاج بعض بيتا غلوبين ولكن بكميات منخفضة. تسمى الكمية المخفضة من بيتا غلوبين بالثلاسيميا بيتا بلس (β+). ومع ذلك، فإن وجود إما β0 أو β+ من الثلاسيميا لا يتنبأ بالضرورة بخطورة المرض؛ تم تشخيص إصابة الأشخاص المصابين بكلا النوعين بالثلاسيميا الكبرى والثلاسيميا المتوسطة.[7]
طرق الانتقال
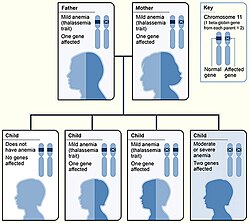
[عدل]ينتقل المرض عن طريق الوراثة المتنحية، فمن أجل ولادة طفل يحمل مرض الثلاسيميا يجب على كلا الابوين أن يكونا حاملين لجين المرض.
عندما يكون كلا الأبوين حاملين لجين المرض فإن أي طفل ينجبانه تكون لديه احتمالية 25% للإصابة بمرض بيتا ثلاسيميا (في حالة وراثته لنسختين من جين المرض)، واحتمالية 50% لأن يكون حاملاً للجين (في حالة وراثته لنسخة واحدة من جين المرض)، واحتمالية 25% ألا يكون حاملاً للجين.[8]
السلسلة بيتا
[عدل]يتكون اليحمور من 4 سلاسل جلوبيلن globin chain والHeme، وفي الشخص الطبيعي البالغ يوجد أربعة سلاسل، سلسلتين ألفا وسلسلتين بيتا ويسمى هذه النوع باليحمور اليفعي، أما النوعان الآخران فهما اليحمور A2 وهيموغلوبين الأطفال (أغلب اليحمور الموجود في مرحلة الطفولة) وأي خلل في تكوين السلسلة بيتا، يؤدي إلى زيادة في الأنواع الأخرى.
تصنيف البيتا ثلاسيميا
[عدل]| الاسم | الوصف | الألائل |
|---|---|---|
| بيتا ثلاسيميا الصغرى | قد تسبب هذه الحالة شكلاً خفيفاً من فقر الدم، ولكنها عادةً لا تتطلب علاجاً طبياً.[9] | β+/β
أو βo/β يحمل الشخص أليلاً واحداً سليماً، وآخر معطوباً يحمل طفرة المرض. |
| بيتا ثلاسيميا المتوسطة | يعاني الشخص المصاب من أعراض تقع بين الثلاسيميا الصغرى والكبرى، مثل فقر الدم المتوسط، وقد يحتاج إلى عمليات نقل خلايا الدم الحمراء بشكل متقطع.[9] | β+/β+
نسختين من الأليل β+ أو βo/β+ أليل (β+) وأليل (βo) |
| بيتا ثلاسيميا الكبرى | يحتاج الشخص المصاب إلى رعاية طبية مدى الحياة، ونقل خلايا الدم الحمراء، والعلاج بالاستخلاب لإزالة الحديد الزائد من الدم.[9] | βo/βo |
علاج المرض
[عدل]- نقل الدم الدوري وذلك كل 21 يوما أو شهر وأحيانا شهر ونصف شهرين. ويمكن علاجه بزراعة نخاع العظم، وكذلك بالعلاج الجيني.
علاج اكساغامغلوغين اوتوتيمسيل (Exagamglogene autotemcel) أو كاسجفي (Casgevy) هو علاج يعمل باستخدام تقنية التحرير الجيني "كريسبر-كاس9"، ويستخدم لعلاج مريض البيتا ثلاسيميا أو مريض الأنيميا المنجلية الذي يبلغ من العمر 12 سنة فأكثر، يعمل العلاج بطريقة التحرير الجيني للطفرة الوراثية في الجين المتأثر، بحيث يمكن للجسم إنتاج الهيموغلوبين بشكل سليم، من خلال استخلاص خلايا جذعية من نخاع عظم المريض وتحريرها جينياً في المختبر، ومن ثم إعادة زراعتها في جسم المريض ليعطي مفعولاً طويل المدى.[10][11]
الوقاية
[عدل]من أجل الوقاية من الإصابة بمرض بيتا ثلاسيميا يخضع الزوجان أو الشخصان الراغبان بالزواج لفحص وراثي لمعرفة ما إن كانا حاملين لجين مرض بيتا ثلاسيميا، خاصة إذا كان لدى أحدهما تاريخ عائلي للإصابة بمرض بيتا ثلاسيميا.[12]
وفي حالة تبين أن كلا الزوجين حاملان للجين فيمكنهما إنجاب طفل غير مصاب بالمرض عن طريق عمل تلقيح اصطناعي، مع تشخيص وراثي قبل زرع الجنين، حيث يتم اختبار الجنين لمعرفة ما إن كان يحمل الخلل الجيني، ويوضع الجنين غير المصاب في رحم الأم.[13]
مرض ثلاسيميا بيتا المنجلية
[عدل]الثلاسيميا بيتا المنجلية هو مرض وراثي في الدم، ناتج عن وراثة كل من الجين المسبب لمرض الخلايا المنجلية والجين المسبب لثلاسيميا بيتا، حيث تقع الطفرات المسببة لمرض الخلايا المنجلية والثلاسيميا بيتا في نفس الجين، جين HBB، الذي يقع في الكروموسوم 11 لدى الإنسان.[14][6]
عندما يكون أحد الزوجين حاملاً لجين بيتا ثلاسيميا والآخر حاملاً لجين الأنيميا المنجلية فإنه تكون لدى أي طفل ينجبانه احتمالية 25% بأن يصاب بمرض ثلاسيميا بيتا المنجلية (في حالة وراثته لكل من جين مرض الخلايا المنجلية وجين بيتا ثلاسيميا)، واحتمالية 25% أن يكون حاملاً لجين فقر الدم المنجلي (دون الإصابة به)، واحتمالية 25% أن يكون حاملاً لجين بيتا ثلاسيميا (دون الإصابة بها)، واحتمالية 25% ألا يحمل أياً من الجينين.[8]
المراجع
[عدل]- ^ Disease Ontology (بالإنجليزية), 27 May 2016, QID:Q5282129
- ^ Monarch Disease Ontology release 2018-06-29 (ط. 2018-06-29)، 29 يونيو 2018، QID:Q55345445
- ^ "معلومات عن ثلاسيميا بيتا على موقع meshb.nlm.nih.gov". meshb.nlm.nih.gov. مؤرشف من الأصل في 2019-08-24.
- ^ OMIM: 603902
- ^ "معلومات عن ثلاسيميا بيتا على موقع disease-ontology.org". disease-ontology.org. مؤرشف من الأصل في 2018-10-15.
- ^ ا ب ج د ه "HBB gene: MedlinePlus Genetics". medlineplus.gov (بالإنجليزية). Archived from the original on 2023-12-01. Retrieved 2024-03-02.
- ^ "Beta thalassemia: MedlinePlus Genetics". medlineplus.gov (بالإنجليزية). Archived from the original on 2023-10-31. Retrieved 2024-03-02.
- ^ ا ب "Beta Thalassemia Trait". www.stjude.org (بالإنجليزية). Archived from the original on 2024-03-01. Retrieved 2024-03-02.
- ^ ا ب ج "Beta Thalassemia Minor: Symptoms of Inherited Trait". Verywell Health (بالإنجليزية). Archived from the original on 2024-01-25. Retrieved 2024-03-02.
- ^ "الهيئة العامة للغذاء والدواء تعتمد أول علاج جيني لفقر الدم المنجلي و "الثلاسيميا" | الهيئة العامة للغذاء والدواء". www.sfda.gov.sa. 29 فبراير 2024. مؤرشف من الأصل في 2024-02-11. اطلع عليه بتاريخ 2024-03-02.
- ^ "MHRA authorises world-first gene therapy that aims to cure sickle-cell disease and transfusion-dependent β-thalassemia". GOV.UK (بالإنجليزية). Archived from the original on 2023-11-17. Retrieved 2024-08-15.
- ^ "الفحص ما قبل الزواج / الحمل - Fakih IVF Qatar Fertility Center is one of the leading Infertility, Gynecology, Obstetrics, Genetics and IVF centers in the GCC Region". Fakih IVF Qatar Fertility Center is one of the leading Infertility, Gynecology, Obstetrics, Genetics and IVF centers in the GCC Region. - Fakih IVF Qatar Fertility Center is one of the leading Infertility, Gynecology, Obstetrics, Genetics and IVF centers in the GCC Region. (بالإنجليزية). 16 Apr 2021. Archived from the original on 2023-12-08. Retrieved 2024-08-14.
- ^ "تشخيص وراثي قبل الزرع لناقلي الاضطرابات الوراثية". PGD Labs Kuwait. مؤرشف من الأصل في 2023-09-28. اطلع عليه بتاريخ 2024-08-14.
- ^ "Sickle cell beta thalassemia: Causes, symptoms, and treatments". www.medicalnewstoday.com (بالإنجليزية). 21 Jun 2022. Archived from the original on 2023-11-28. Retrieved 2024-08-14.
- موقع أمراض الدم والثلاسيميا.