تفاعل حول حلقي: الفرق بين النسختين
| [نسخة منشورة] | [نسخة معلقة] |
Mr.Ibrahembot (نقاش | مساهمات) ط بوت: أضاف قالب:معرفات مركب كيميائي |
Mr.Ibrahembot (نقاش | مساهمات) ط بوت: إضافة وصلة أرشيفية. |
||
| (7 مراجعات متوسطة بواسطة 3 مستخدمين غير معروضة) | |||
| سطر 1: | سطر 1: | ||
{{مصادر أكثر|تفاصيل = بحاجة للاستشهاد بمعجم مطبوع بدلاً عن قاعدة بيانات معجمية على الإنترنت}} |
{{مصادر أكثر|تفاصيل = بحاجة للاستشهاد بمعجم مطبوع بدلاً عن قاعدة بيانات معجمية على الإنترنت}} |
||
[[ملف:Cycloheptatriene-Norcaradiene Rearrangement.png|يسار|300px|مثال على تفاعل حول حلقي]] |
[[ملف:Cycloheptatriene-Norcaradiene Rearrangement.png|يسار|300px|مثال على تفاعل حول حلقي]] |
||
'''التفاعل حول الحلقي''' في [[كيمياء عضوية|الكيمياء العضوية]] هو نوع من أنواع [[تفاعل عضوي|التفاعلات العضوية]] تكون فيه [[حالة انتقالية|الحالة الانتقالية]] للجزيء ذات بنية حلقية، ويسير التفاعل وفق أسلوب [[تفاعل تنظيم|منتظم ومتسق]]. غالباً ما تكون التفاعلات حول الحلقية عبارة عن تفاعلات [[تفاعل إعادة ترتيب|إعادة ترتيب]]. |
'''التفاعل حول الحلقي''' في [[كيمياء عضوية|الكيمياء العضوية]] هو نوع من أنواع [[تفاعل عضوي|التفاعلات العضوية]] تكون فيه [[حالة انتقالية|الحالة الانتقالية]] للجزيء ذات بنية حلقية، ويسير التفاعل وفق أسلوب [[تفاعل تنظيم|منتظم ومتسق]]. غالباً ما تكون التفاعلات حول الحلقية عبارة عن تفاعلات [[تفاعل إعادة ترتيب|إعادة ترتيب]]. |
||
من أصناف التفاعلات حول الحلقية كل من [[تفاعل حلقي إلكتروني|التفاعلات الحلقية الإلكترونية]] و[[إضافة حلقية|الإضافة الحلقية]]. |
من أصناف التفاعلات حول الحلقية كل من [[تفاعل حلقي إلكتروني|التفاعلات الحلقية الإلكترونية]] و[[إضافة حلقية|الإضافة الحلقية]]. |
||
| سطر 10: | سطر 10: | ||
* طريقة المدارات الحدودية وفق أسلوب [[كينيتشي فوكوي]].<ref>Kenichi Fukui: The Role of Frontier Orbitals in Chemical Reactions (Nobel Lecture). In: Angewandte Chemie International Edition. Band 21, Nr. 11, 1982, S. 801–809, doi:10.1002/anie.198208013</ref> |
* طريقة المدارات الحدودية وفق أسلوب [[كينيتشي فوكوي]].<ref>Kenichi Fukui: The Role of Frontier Orbitals in Chemical Reactions (Nobel Lecture). In: Angewandte Chemie International Edition. Band 21, Nr. 11, 1982, S. 801–809, doi:10.1002/anie.198208013</ref> |
||
* مبدأ الحالة الانتقالية العطرية وفق أسلوب ''ديوار'' ''Dewar'' و ''تسيمرمان'' ''Zimmerman'' و ''إيفانز'' ''Evans''. |
* مبدأ الحالة الانتقالية العطرية وفق أسلوب ''ديوار'' ''Dewar'' و ''تسيمرمان'' ''Zimmerman'' و ''إيفانز'' ''Evans''. |
||
== آلية التفاعل الدوري == |
|||
بحكم التعريف تستمر التفاعلات الدورية من خلال آلية منسقة تتضمن حالة انتقالية دورية واحدة. ولهذا السبب، قبل الفهم المنهجي للعمليات الدورية من خلال مبدأ الحفاظ على التناظر المداري، تمت الإشارة إليها بشكل خادع باسم "التفاعلات غير الآلية". ومع ذلك، فإن التفاعلات التي يمكن رسم آليات محيطية لها غالبًا ما يكون لها آليات تدريجية مترابطة تمر عبر وسيط جذري أو ثنائي القطب تكون أيضًا قابلة للحياة. بعض فئات التفاعلات الدورية، مثل تفاعلات الإضافة الحلقية [2+2] الكيتينية، يمكن أن تكون "مثيرة للجدل" لأن آليتها في بعض الأحيان لا تُعرف بشكل قاطع بأنها منسقة (أو قد تعتمد على النظام التفاعلي). علاوة على ذلك، غالبًا ما يكون للتفاعلات محيطية الحلقة أيضًا نظائرها محفزة بالمعادن، على الرغم من أن هذه التفاعلات عادةً ليست تفاعلات محيطية حلقية من الناحية الفنية، نظرًا لأنها تتم عبر وسائط مثبتة بالمعادن، وبالتالي فهي غير متناسقة. |
|||
إن الحالات الانتقالية المقابلة (4n + 2)-electron Möbius و4n-electron Hückel هي حالات انتقالية مضادة للروائح وبالتالي فهي غير مفضلة بشدة. تؤدي نظرية الحالة الانتقالية العطرية إلى بيان بسيط بشكل خاص لقواعد وودوارد-هوفمان المعممة: التفاعل الدوري الذي يتضمن عددًا فرديًا من أزواج الإلكترونات سوف يستمر من خلال حالة انتقال هوكل (عدد زوجي من مكونات الوجه المضاد في مصطلحات وودوارد-هوفمان)<ref>It can be shown that the number of nodes that occur in the overlapping orbitals of a pericyclic transition state and the number of antarafacial components must have the same parity (regardless of the sign conventions used to make these assignments).</ref> في حين أن سوف يستمر التفاعل الدوري الذي يتضمن عددًا زوجيًا من أزواج الإلكترونات من خلال حالة انتقال موبيوس (عدد فردي من مكونات الوجه الأمامي). |
|||
== في الكيمياء الحيوية == |
|||
تحدث التفاعلات الدورية أيضًا في العديد من العمليات البيولوجية: |
|||
* إعادة ترتيب كلايزن للكوريسمات ليُحدث ما قبله في جميع الكائنات الحية الأولية تقريبًا |
|||
* [1،5] - تحول سيجماتروبي في تحول البريكورين-8x إلى حمض هيدروجينوبيرينيك |
|||
* فتح حلقة كهروحلقية كهربائية غير إنزيمية وكيميائية ضوئية وتحول هيدريد سيجماتروبيك (1،7) في تخليق فيتامين د |
|||
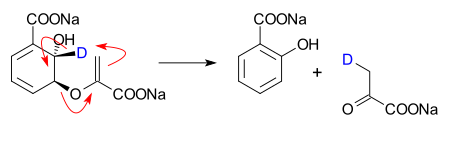
* يحفز لياز البيروفات الإيزوكوريسمات تحويل الإيزوكوريسمات إلى الساليسيلات والبيروفات<ref>''Isochorismate Pyruvate Lyase: A Pericyclic Reaction Mechanism?'' Michael S. DeClue, Kim K. Baldridge, Dominik E. Künzler, Peter Kast, and Donald Hilvert [[J. Am. Chem. Soc.]]؛ '''2005'''; 127(43) pp 15002 - 15003; (Communication) {{دوي|10.1021/ja055871t}}</ref> |
|||
[[ملف:IsochorismatePyruvateLyase.svg|وصلة=https://en.wikipedia.org/wiki/File:IsochorismatePyruvateLyase.svg|Isochorismate pyruvate lyase converts isochorismate into salicylate and pyruvate]] |
|||
== اقرأ أيضاً == |
== اقرأ أيضاً == |
||
| سطر 19: | سطر 34: | ||
== المراجع == |
== المراجع == |
||
{{مراجع}} |
{{مراجع}} |
||
| ⚫ | |||
{{ضبط استنادي}} |
{{ضبط استنادي}} |
||
{{معرفات مركب كيميائي}} |
{{معرفات مركب كيميائي}} |
||
| ⚫ | |||
{{شريط بوابات|الكيمياء}} |
{{شريط بوابات|الكيمياء}} |
||
النسخة الحالية 02:03، 17 ديسمبر 2024
تحتاج هذه المقالة إلى الاستشهاد بمصادر إضافية لتحسين وثوقيتها. |

التفاعل حول الحلقي في الكيمياء العضوية هو نوع من أنواع التفاعلات العضوية تكون فيه الحالة الانتقالية للجزيء ذات بنية حلقية، ويسير التفاعل وفق أسلوب منتظم ومتسق. غالباً ما تكون التفاعلات حول الحلقية عبارة عن تفاعلات إعادة ترتيب. التفاعل المحيطي هو التفاعل الذي تتم فيه إعادة تنظيم منسقة للروابط من خلال مجموعة دائرية من الذرات (غالبًا ما تتضمن ست ذرات) مرتبطة بشكل دائم.[1][2] والحالة الانتقالية لها هندسة دورية.
من أصناف التفاعلات حول الحلقية كل من التفاعلات الحلقية الإلكترونية والإضافة الحلقية.
المبدأ
[عدل]هناك أربعة مبادئ وطرق لشرح التفاعلية الكيميائية في التفاعلات حول الحلقية:
- مخططات تداخل المدارات وفق طريقة روبرت وودورد ورولد هوفمان.[3] أو طريقة أعلى مدارات جزيئية مشغولة لنفس العالمين.
- طريقة المدارات الحدودية وفق أسلوب كينيتشي فوكوي.[4]
- مبدأ الحالة الانتقالية العطرية وفق أسلوب ديوار Dewar و تسيمرمان Zimmerman و إيفانز Evans.
آلية التفاعل الدوري
[عدل]بحكم التعريف تستمر التفاعلات الدورية من خلال ��لية منسقة تتضمن حالة انتقالية دورية واحدة. ولهذا السبب، قبل الفهم المنهجي للعمليات الدورية من خلال مبدأ الحفاظ على التناظر المداري، تمت الإشارة إليها بشكل خادع باسم "التفاعلات غير الآلية". ومع ذلك، فإن التفاعلات التي يمكن رسم آليات محيطية لها غالبًا ما يكون لها آليات تدريجية مترابطة تمر عبر وسيط جذري أو ثنائي القطب تكون أيضًا قابلة للحياة. بعض فئات التفاعلات الدورية، مثل تفاعلات الإضافة الحلقية [2+2] الكيتينية، يمكن أن تكون "مثيرة للجدل" لأن آليتها في بعض الأحيان لا تُعرف بشكل قاطع بأنها منسقة (أو قد تعتمد على النظام التفاعلي). علاوة على ذلك، غالبًا ما يكون للتفاعلات محيطية الحلقة أيضًا نظائرها محفزة بالمعادن، على الرغم من أن هذه التفاعلات عادةً ليست تفاعلات محيطية حلقية من الناحية الفنية، نظرًا لأنها تتم عبر وسائط مثبتة بالمعادن، وبالتالي فهي غير متناسقة.
إن الحالات الانتقالية المقابلة (4n + 2)-electron Möbius و4n-electron Hückel هي حالات انتقالية مضادة للروائح وبالتالي فهي غير مفضلة بشدة. تؤدي نظرية الحالة الانتقالية العطرية إلى بيان بسيط بشكل خاص لقواعد وودوارد-هوفمان المعممة: التفاعل الدوري الذي يتضمن عددًا فرديًا من أزواج الإلكترونات سوف يستمر من خلال حالة انتقال هوكل (عدد زوجي من مكونات الوجه المضاد في مصطلحات وودوارد-هوفمان)[5] في حين أن سوف يستمر التفاعل الدوري الذي يتضمن عددًا زوجيًا من أزواج الإلكترونات من خلال حالة انتقال موبيوس (عدد فردي من مكونات الوجه الأمامي).
في الكيمياء الحيوية
[عدل]تحدث التفاعلات الدورية أيضًا في العديد من العمليات البيولوجية:
- إعادة ترتيب كلايزن للكوريسمات ليُحدث ما قبله في جميع الكائنات الحية الأولية تقريبًا
- [1،5] - تحول سيجماتروبي في تحول البريكورين-8x إلى حمض هيدروجينوبيرينيك
- فتح حلقة كهروحلقية كهربائية غير إنزيمية وكيميائية ضوئية وتحول هيدريد سيجماتروبيك (1،7) في تخليق فيتامين د
- يحفز لياز البيروفات الإيزوكوريسمات تحويل الإيزوكوريسمات إلى الساليسيلات والبيروفات[6]
اقرأ أيضاً
[عدل]ملاحظات
[عدل]
المراجع
[عدل]- ^ قالب:GoldBook
- ^ Chemistry (IUPAC)، The International Union of Pure and Applied. "IUPAC - pericyclic reaction (P04491)". goldbook.iupac.org. مؤرشف من الأصل في 2024-05-09. اطلع عليه بتاريخ 2024-08-30.
- ^ R. B. Woodward, Roald Hoffmann: The Conservation of Orbital Symmetry. In: Angewandte Chemie International Edition. Band 8, Nr. 11, 1969, pages:. 781–853, doi:10.1002/anie.196907811.
- ^ Kenichi Fukui: The Role of Frontier Orbitals in Chemical Reactions (Nobel Lecture). In: Angewandte Chemie International Edition. Band 21, Nr. 11, 1982, S. 801–809, doi:10.1002/anie.198208013
- ^ It can be shown that the number of nodes that occur in the overlapping orbitals of a pericyclic transition state and the number of antarafacial components must have the same parity (regardless of the sign conventions used to make these assignments).
- ^ Isochorismate Pyruvate Lyase: A Pericyclic Reaction Mechanism? Michael S. DeClue, Kim K. Baldridge, Dominik E. Künzler, Peter Kast, and Donald Hilvert J. Am. Chem. Soc.؛ 2005; 127(43) pp 15002 - 15003; (Communication) دُوِي:10.1021/ja055871t