硝酸盐
外观
(重定向自硝酸鹽)
| 硝酸盐 | |
|---|---|

| |
| 系统名 Nitrate | |
| 识别 | |
| CAS号 | 14797-55-8 |
| PubChem | 943 |
| ChemSpider | 918 |
| SMILES |
|
| InChI |
|
| InChIKey | NHNBFGGVMKEFGY-UHFFFAOYAI |
| ChEBI | 17632 |
| 性质 | |
| 化学式 | NO3− |
| 摩尔质量 | 62.004 g·mol⁻¹ |
| 若非注明,所有数据均出自标准状态(25 ℃,100 kPa)下。 | |

硝酸鹽(英語:nitrate)是一個多原子離子其分子式NO3−和分子量62.0049克/mol。关于含有機官能團RONO2的物质,参见硝酸酯。
结构
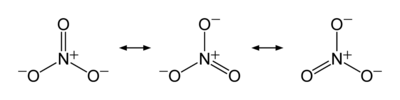
[编辑]与碳酸根离子类似,硝酸根离子的分子构型是平面三角形,并且具有以下共振式:
制备
[编辑]硝酸与金属、金属氧化物或碳酸盐反应是最简单的制备硝酸盐的方法。某些含水的硝酸盐如Be(NO3)2,Mg(NO3)2和Cu(NO3)2加热後會分解 ,因此得不到相应的无水硝酸盐。无水硝酸盐可通过下列途径制得:[1]
- 在液态N2O4中反应:
- Ni(CO)4 + N2O4 → Ni(NO3)2 + 2NO + 4CO
- 在纯HNO3-N2O5或液态N2O5中反应:
- TiCl4 + 4N2O5 → Ti(NO3)4 + 2N2O4 + 2Cl2
- TiCl4 + 4ClNO3 −(-80℃)→ Ti(NO3)4 + 2Cl2
某些金属还可形成通式为MOx(NO3)y的碱式硝酸盐,如BiO(NO3)2。
大多数硝酸盐为离子型晶体,易溶于水。某些无水盐具有挥发性。
性质
[编辑]热不稳定性
[编辑]硝酸盐分解的产物可以分为以下几类:
- 2 KNO3 → 2 KNO2 + O2↑
- 2 Pb(NO3)2 → 2 PbO + 4 NO2↑ + O2↑
- 4 Bi(NO3)3 → 2 Bi2O3 + 12 NO2↑ + 3 O2↑
- Th(NO3)4 → ThO2 + 4 NO2 + O2↑
- 金属活动性位于Cu之后的产生金属单质:
- 2 AgNO3 → 2 Ag + 2 NO2↑+ O2↑
- 含有还原性阳离子的硝酸盐热分解时,会和硝酸根发生氧化还原反应:
- NH4NO3 → N2O、N2 + ……
- Mn(NO3)2 → MnO2 + ……
- Ce(NO3)3 → CeO2 + ……
- 需要注意的是,一些物质在分解至最终产物之前,会产生中间产物,如La(NO3)3 → LaONO3 → La2O3等。
- 铜(II)、钛(IV)、钴(III)、锆(IV)的无水硝酸盐受热可以以气态的形式存在。
氧化性
[编辑]硝酸盐都是氧化剂,其固态或液态的氧化性远大于溶液中的氧化性。如硝酸钾溶液和碳不会反应,但是硝酸钾固体和碳加热,会剧烈反应(反应热使硝酸钾熔化)。
检验
[编辑]硝酸根离子可在酸性介质中,通过和铁(II)反应产生棕色环加以定性检出。参见棕色环实验。
总反应为:
- 3Fe2+ + NO3− + 4H+ → 3Fe3+ + NO + 2H2O
虽然该反应已有很久的历史,但其机理却是不久前经分光光度法及电位滴定法的系统研究后才弄清楚的:[2]
- Fe2+ + NO3− + 2H+ → Fe3+ + NO2 + H2O
- Fe2+ + NO2 + H+ → Fe3+ + HNO2
- Fe2+ + HNO2 + H+ → Fe3+ + NO + H2O
- Fe2+ + NO → FeNO2+
- 2NO2 + H2O → HNO2 + NO3− + H+
- 2HNO2 → NO + NO2 + H2O
- NO + NO3− + H+ → NO2 + HNO2
其中棕色环是由FeNO2+(第四步)引起的,速控步则是最后一步。
硫酸-二苯胺法也能用于硝酸根的检验。
配位化合物
[编辑]硝酸根和金属离子可以按多种方式配位,包括单齿、双齿、叁齿或端梢、桥式等。
参见
[编辑]参考文献
[编辑]- ^ 张青莲等。《无机化学丛书》第四卷 氮磷砷分族。北京:科学出版社。
- ^ I. R. Epstein, K. Kustin and L. J. Warshaw, J. Am. Chem. Soc. 102:3751 (1980).