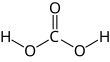
กรดคาร์บอนิก
กรดคาร์บอนิก (อังกฤษ: Carbonic acid) เป็นกรดชนิดหนึ่งที่มีอะตอมของคาร์บอนเป็นส่วนประกอบ มีสูตรโมเลกุล H2CO3 กรดคาร์บอนิกยังใช้เป็นคำเรียกสารละลายของคาร์บอนไดออกไซด์ในน้ำ ซึ่งมี H2CO3 อยู่เล็กน้อย เราเรียกเกลือของกรดคาร์บอนิกว่า ไบคาร์บอเนต (หรือ ไฮโดรเจนคาร์บอเนต) และ คาร์บอเนต
| |||
| ชื่อ | |||
|---|---|---|---|
| ชื่ออื่น
Carbon dioxide solution, dihydrogen carbonate (IUPAC)
| |||
| เลขทะเบียน | |||
3D model (JSmol)
|
|||
| เคมสไปเดอร์ | |||
| ECHA InfoCard | 100.133.015 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| คุณสมบัติ | |||
| H2CO3 | |||
| มวลโมเลกุล | 62.03 g/mol | ||
| ความหนาแน่น | 1.0 g/cm3 (dilute soln.) | ||
| จุดหลอมเหลว | n/a | ||
| exists only in solution | |||
| pKa | 10.25 | ||
หากมิได้ระบุเป็นอื่น ข้อมูลข้างต้นนี้คือข้อมูลสาร ณ ภาวะมาตรฐานที่ 25 °C, 100 kPa
| |||
คาร์บอนไดออกไซด์ที่ละลายน้ำเกิดสมดุลเคมีกับกรดคาร์บอนิก ดังสมการต่อนี้
- CO2 + H2O → H2CO3
ค่าคงที่สมดุลที่ 25 °C เท่ากับ 1.70×10−3: ดังนั้นคาร์บอนไดออกไซด์ส่วนใหญ่จะไม่เปลี่ยนเป็นกรดคาร์บอนิกและยังคงอยู่เป็นโมเลกุล CO2 ถ้าหากไม่มีตัวเร่งปฏิกิริยา สมดุลข้างต้นจะเกิดขึ้นช้า โดยมีอัตราการเกิดปฏิกิริยา (rate constant) เท่ากับ 0.039 s−2 สำหรับขาไป
- (CO2 + H2O → H2CO3)
และ 23 s−1 สำหรับปฏิกิริยาย้อนกลับ
- (H2CO3 → CO2 + H2O).
สมดุลระหว่างคาร์บอนไดออกไซด์และกรดคาร์บอนิก มีความสำคัญมากสำหรับการควบคุมความเป็นกรดของของเหลวในร่างกาย สิ่งมีชีวิตเกือบทุกชนิดมีเอนไซม์ชื่อคาร์บอนิกแอนไฮเดรส เป็นตัวเร่งปฏิกิริยาระหว่างสารประกอบสองตัวนี้ โดยสามารถเร่งปฏิกิริยาให้เร็วขึ้นถึง 109 เท่า
อ้างอิง
แก้- Welch, M. J.; Lipton, J. F.; Seck, J. A. (1969). J. Phys. Chem. 73:3351.
- Jolly, W. L. (1991). Modern Inorganic Chemistry (2nd Edn.). New York:MgGraw-Hill. ISBN 0-07-112651-1.