1,4-dioxán: Rozdiel medzi revíziami
d robot Pridal: ko:1,4-다이옥산 |
d - co tam robila ta lebcicka? dioxan nie je jedovaty (ld50 na urovni 5g/kg je mrte vela), ak tak by tam patrilo X-ko (irritant), ale urcite ne lebka... |
||
| Riadok 28: | Riadok 28: | ||
| MSDS = |
| MSDS = |
||
}} |
}} |
||
{{Jed}} |
|||
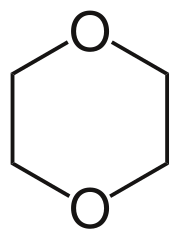
'''1,4-dioxán''' je bezfarebná kvapalina, slabo éterického zápachu. Po chemickej stránke je to [[Heterocyklické zlúčeniny|heterocyklická zlúčenina]] s jedným šesťčlenným kruhom, obsahujúcom dva [[kyslík]]ové atómy. Možno ho však považovať aj za cyklický [[etéry|etér]]. |
'''1,4-dioxán''' je bezfarebná kvapalina, slabo éterického zápachu. Po chemickej stránke je to [[Heterocyklické zlúčeniny|heterocyklická zlúčenina]] s jedným šesťčlenným kruhom, obsahujúcom dva [[kyslík]]ové atómy. Možno ho však považovať aj za cyklický [[etéry|etér]]. |
||
Verzia z 21:29, 23. január 2009
| 1,4-dioxán | |
 | |
 | |
| Všeobecné vlastnosti | |
| Sumárny vzorec | C4H8O2 |
| Vzhľad | bezfarebná kvapalina s éterickým zápachom |
| Fyzikálne vlastnosti | |
| Molárna hmotnosť | 88,10632 g/mol |
| Teplota topenia | 11,8 °C |
| Teplota varu | 101,5 °C |
| Hustota | 1,033 g/cm³ (20 °C) |
| Ďalšie informácie | |
| Číslo CAS | 123-91-1 |
| Pokiaľ je to možné a bežné, používame jednotky sústavy SI. Ak nie je hore uvedené inak, údaje sú za normálnych podmienok. | |
1,4-dioxán je bezfarebná kvapalina, slabo éterického zápachu. Po chemickej stránke je to heterocyklická zlúčenina s jedným šesťčlenným kruhom, obsahujúcom dva kyslíkové atómy. Možno ho však považovať aj za cyklický etér.
Od jeho štruktúry sú okrem iného odvodené zlúčeniny súhrne označované ako dioxíny, patriace k nebezpečným látkam znečisťujúcim prírodne prostredie.
Vznik
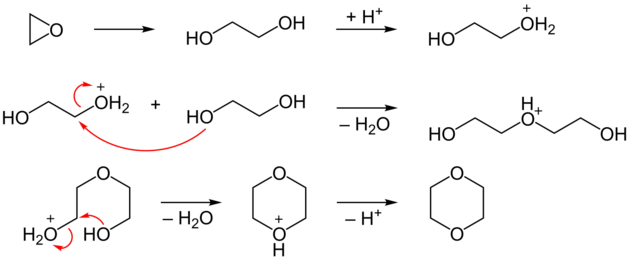
Vzniká napr. dimerizáciou etylénoxidu v kyslom prostredí za prítomnosti vody
Reakcia prebieha dvojstupňovo, medziproduktom je etylénglykol:
Vlastnosti
Látka je neobmedzene miešateľná s vodou. Je rozpustná tak v polárnych organických rozpúšťadlách (napr. v etanole), ako aj v nepolárnych (napr. v benzéne). Je silno horľavá, jej pary v zmesi so vzduchom sú výbušné v rozmedzí koncentrácií 2 až 22 %.
Pri dlhodobom styku s vzdušným kyslíkom môžu vznikať peroxidické deriváty dioxánu, ktoré sú za určitých podmienok náchylné k explóziám. Postupne sa oxiduje, hlavne za súčasného pôsobenia slnečného žiarenia, až na oxid uhoľnatý.
Zdravotné účinky
Je jedovatý pre živočíchy vrátane človeka, veľmi toxický pri vdychovaní pár. Otrava sa prejavuje podráždením dýchacieho aparátu, bolesťami hlavy, nevoľnosťou až zvracaním. Doprevádzajú ju halucinácie a neskôr bezvedomie. Môže spôsobiť trvalé poškodenie pečene a mozgu, prípadne aj smrť, ktorá býva spôsobená zlyhaním obličiek. Nebezpečné je, že otrava nemáva celkom jasné príznaky, preto môže byť prvá pomoc zanedbaná. Smrteľná dávka LD50 u myší pri podaní v potrave je 5,3 g/kg živej hmotnosti, u krýs 4,2 g/kg. Na základe výsledkov pokusov na zvieratách je IARC klasifikovaný v skupine 2B - ako pravdepodobný karcinogén.
Použitie
Používa sa predovšetkým v laboratóriách a v chemickej výrobe ako rozpúšťadlo. Okrem toho býva používaný ako riedidlo v lakoch a iných náterových hmotách, v tmeloch a lepidlách a ako stabilizačná prísada k prostriedkom pre chemické čistenie odevov (napr. k 1,1,1-trichlóretánu). Používa sa tiež v biológii a v lekárstve pri príprave vzorkou pre mikroskopické skúmanie.
Ultračistý 1,4-dioxán sa používa aj ako náplň scintilačných detektorov ionizujúceho zariadenia.
Externé odkazy
- 1,4-dioxán dokument vo formáte PDF (po slovensky)
- 1,4-Dioxane CAS No. 123-91-1 dokument vo formáte PDF (po anglicky)