Рак лёгкого (бронхогенный рак, бронхогенная карцинома, разг. рак лёгких) — злокачественное новообразование лёгкого, происходящее из эп��телиальной ткани бронхов различного калибра. В зависимости от места появления подразделяется на центральный, периферический и массивный (смешанный).
| Рак лёгкого | |
|---|---|
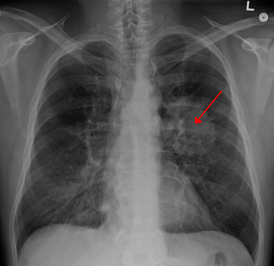 Рентгенограмма грудной клетки, демонстрирующая опухоль в лёгких | |
| МКБ-11 | 2C25 |
| МКБ-10 | C33-C34 |
| МКБ-10-КМ | C34.2, C34.1 и C34.3 |
| МКБ-9 | 162 |
| МКБ-9-КМ | 162.3[1], 162.5[1], 162.8[1] и 162.4[1] |
| OMIM | 211980, 608935, 612593, 614210 и 612571 |
| DiseasesDB | 7616 |
| MedlinePlus | 007194 |
| eMedicine | med/1333 med/1336 emerg/335 radio/807 radio/405 radio/406 |
| MeSH | D002283 |
Эпидемиология
правитьРак лёгкого является серьёзной медицинской и социальной проблемой, в развитых странах он является наиболее часто встречающейся злокачественной опухолью и является наиболее распространённой причиной смерти от онкологической патологии. Согласно данным международного агентства по изучению рака, ежегодно в мире регистрируется около 1 миллиона новых случаев рака лёгкого, и 60 % онкологических больных погибает в результате данного заболевания.[2]
В России рак лёгкого также занимает 1 место среди онкологических заболеваний и его доля в данной патологии составляет 12 %, в 15 % случаев у умерших онкобольных был выставлен диагноз рак лёгкого. Мужчины болеют раком лёгкого значительно чаще, каждая 4-я злокачественная опухоль у мужчин является раком лёгкого, у женщин же — только каждая 12-я. По данным 2000 года рак лёгкого стал причиной смерти 32 % мужчин, и 7,2 % женщин, у которых были обнаружены какие-либо злокачественные новообразования.[2]
Этиология
правитьК основным причинам любого рака относят канцерогены (например, табачного дыма), ионизирующее излучение и вирусную инфекцию. Их воздействие вызывает кумулятивные изменения ДНК в выстилающей ткани бронхов лёгкого (бронхиальном эпителии). Чем больше тканей повреждено, тем выше риск развития рака[3]. При развитии злокачественного новообразования в лёгких наибольшее значение имеют такие факторы, как радоновая нагрузка и табакокурение.
Курение табака
правитьКурение табака на сегодняшний день — основная причина рака лёгкого[4]. По сравнению с некурящими, у курильщиков риск развития рака лёгких выше примерно в 20 раз[5]. Сигаретный дым содержит более 60 известных канцерогенов,[6] в том числе радиоизотопы радона, нитрозамин и бензпирен. Кроме того, полагают, что никотин подавляет иммунную систему, что способствует озлокачествлению тканей[7]. В развитых странах почти 90 % случаев смертельного рака лёгкого вызваны курением[8]. Среди курящих мужчин пожизненный риск развития рака лёгкого составляет 17,2 %, среди курящих женщин — 11,6 %. Этот риск значительно ниже у некурящих: 1,3 % у мужчин и 1,4 % у женщин[9].
Женщины, которые курят и получают гормональную терапию, имеют гораздо более высокий риск смерти от рака лёгкого. В исследовании, проведённом в 2009 году, было показано, что женщины, принимающие гормоны, имеют на 60 % выше вероятность смерти от рака лёгкого, чем женщины, принимающие плацебо. Среди женщин, которые курили (бывшие и нынешние курильщицы), 3,4 % из них, кто принимал гормоны умерло от рака лёгкого по сравнению с 2,3 % женщин, принимавших плацебо[10].
Со стажем курения табака увеличивается вероятность развития рака лёгкого у человека. Если человек прекращает курить, эта вероятность неуклонно уменьшается, так как повреждённые лёгкие восстанавливаются, и загрязняющие частицы постепенно удаляются[11]. Кроме того, есть свидетельства, что рак лёгкого у никогда не куривших имеет лучший прогноз, чем у курильщиков[12], и поэтому пациенты, которые курят на момент установления диагноза, имеют меньшую выживаемость, чем те, которые давно бросили курить[13].
Пассивное курение (вдыхание дыма табака от другого курильщика) — одна из причин рака лёгкого у некурильщиков. Исследования в США[14], Европе[15], Великобритании[16], и Австралии[17] показали значительное увеличение относительного риска среди тех, кто подвергается пассивному курению. Последние исследования показали, что выдыхаемый курильщиком дым более опасен, чем вдыхание его прямо из сигареты[18]. 10-15 % больных раком лёгкого никогда не курили[19].
Радон
правитьРадон — тяжёлый (поэтому скапливается в подвалах и на нижних этажах зданий) инертный газ без цвета и запаха, образующийся при распаде радия-226, который в свою очередь входит в радиоактивное семейство урана-238, присутствующего в значительных количествах в коре Земли. Радиоактивное излучение радона-222 способно повреждать генетический материал, вызывая мутации, которые чаще всего в случае ненаправленного и случайного по своей сути действия ионизирующего излучения приводят к развитию злокачественных опухолей и малигнизации доброкачественных опухолей, и значительно реже — к наследственным заболеваниям. Воздействие радона — вторая причина рака лёгкого в общей популяции, после курения[20] с увеличением риска от 8 % до 16 % на каждые 100 Бк/м³ увеличения концентрации радона[21]. Концентрация радона в атмосфере зависит от местности и состава основных пород почв и камней. Например, в зонах, таких как Корнуолл в Великобритании (где имеются запасы гранита), радон — большая проблема, и здания должны быть хорошо вентилируемыми для снижения концентрации радона.
Асбестоз
правитьАсбест может вызывать различные лёгочные заболевания, включая рак лёгкого. Существует взаимоусиливающий эффект курения табака и асбестоза в возникновении рака лёгкого[22]. Асбестоз также может вызывать рак плевры, называемый мезотелиома (который следует дифференцировать от рака лёгкого).
Вирусы
правитьВирусы известны способностью вызывать рак лёгкого у животных[23][24], и последние данные свидетельствуют о способности его вызывать у человека. К таким вирусам относят вирус папилломы человека[25], JC-вирус[26], обезьяний вирус 40 (SV40), BK вирус и цитомегаловирус[27]. Эти вирусы могут влиять на клеточный цикл и подавлять апоптоз, способствуя неконтролируемому делению клеток.
Пылевые частицы
правитьИсследования Американского общества рака выявили прямую связь воздействия пылевых частиц с раком лёгкого. Например, если концентрация пыли в воздухе увеличивается только на 1 %, риск развития рака лёгкого возрастает на 14 %[28][29]. Кроме того, установлено, что важен размер частиц пыли, так как ультрадисперсные частицы способны проникать в глубокие слои лёгкого[30].
Классификация рака лёгкого по стадиям
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Согласно отечественной классификации, рак лёгкого подразделяется на следующие стадии:
- I стадия — опухоль от 1 до 3 см в наибольшем измерении, расположена в одном сегменте лёгкого или в пределах сегментарного бронха. Метастазов нет.
- II стадия — опухоль до 6 см в наибольшем измерении, расположена в одном сегменте лёгкого или в пределах сегментарного бронха. Наблюдаются единичные метастазы в пульмональных и бронхопульмональных лимфатических узлах.
- III стадия — опухоль больше 6 см с переходом на соседнюю долю лёгкого или прорастанием соседнего бронха или главного бронха. Метастазы обнаруживаются в бифуркационных, трахеобронхиальных, паратрахеальных лимфатических узлах.
- IV стадия — опухоль выходит за пределы лёгкого с распространением на соседние органы и обширными местными и отдалёнными метастазами, присоединяется плеврит и/или перикардит.
Согласно TNМ-классификации, опухоли определяют:
T — первичная опухоль:
- Тх — недостаточно данных для оценки первичной опухоли либо опухолевые клетки обнаружены только в мокроте или промывных водах бронхов, но не выявлена бронхоскопией и/или другими методами
- Т0 — первичная опухоль не определяется
- Тis — неинвазивный рак (carcinoma in situ)
- Tl — опухоль до 3 см в наибольшем измерении, окружённая лёгочной тканью или висцеральной плеврой без прорастания проксимальнее долевого бронха при бронхоскопии (главный бронх не поражён)
- Т2 — опухоль более 3 см в наибольшем измерении или опухоль любого размера, прорастающая висцеральную плевру, или сопровождающаяся ателектазом, или обструктивной пневмонией, распространяющаяся на корень лёгкого, но не захватывающая всё лёгкое; По данным бронхоскопии, проксимальный край опухоли располагается не менее 2 см от карины.
- ТЗ — опухоль любого размера, переходящая на грудную стенку (в том числе опухоль верхней борозды), диафрагму, медиастинальную плевру, перикард; опухоль, не доходящая до карины менее чем на 2 см, но без вовлечения карины, или опухоль с сопутствующим ателектазом или обструктивной пневмонией всего лёгкого.
- Т4 — опухоль любого размера непосредственно переходящая на средостение, сердце, крупные сосуды, трахею, пищевод, тела позвонков, карину (отдельные опухолевые узлы в той же доле или опухоль со злокачественным плевральным выпотом).
N — регионарные лимфатические узлы
- Nx — недостаточно данных для оценки состояния регионарных лимфатических узлов
- N0 — нет признаков метастатического поражения регионарных лимфатических узлов
- N1 — имеется поражение перибронхиальных и/или лимфатических узлов корня лёгкого на стороне поражения, включая непосредственное распространение опухоли на лимфатические узлы.
- N2 — имеется поражение лимфатических узлов средостения на стороне поражения или бифуркационных лимфатических узлов.
- N3 — поражение лимфатических узлов средостения или корня лёгкого на противоположной стороне: прескаленных или надключичных узлов на стороне поражения или на противоположной стороне
М — отдалённые метастазы
- Мх — недостаточно данных для определения отдалённых метастазов
- М0 — нет признаков отдалённых метастазов
- M1 — имеются признаки отдалённых метастазов, включая отдельные опухолевые узлы в другой доле
- М1а — интраторакальные метастазы, отдельные опухолевые узлы в контралатеральном, противоположном лёгком. Опухоль большого размера, но локализованная в органах грудной полости.
- М1в — экстраторакальные метастазы, метастатические опухоли за пределами грудной полости- в головном мозгу, печени, костях, почках, надпочечниках.
G — гистопатологическая градация
- Gx — степень дифференцировки клеток не может быть оценена
- G1 — высокая степень дифференцировки
- G2 — умеренная степень дифференцировки
- G3 — низкодифференцированная опухоль
- G4 — недифференц��рованная опухоль
Гистологическая классификация рака лёгкого
править| Гистологический тип | Частота (в %) |
|---|---|
| Немелкоклеточный[англ.] рак лёгкого | 80.4 |
| Мелкоклеточный рак лёгкого | 16.8 |
| Карциноид[32] | 0.8 |
| Саркома[33] | 0.1 |
| Неуточнённая злокачественная опухоль лёгкого | 1.9 |
Согласно гистологической классификации рак лёгкого подразделяется на следующие виды:
I. Плоскоклеточный (эпидермоидный) рак
- а) высокодифференцированный
- б) умеренно дифференцированный
- в) малодифференцированный
- а) овсяноклеточный, веретёноклеточный
- б) плеоморфный
III. Аденокарцинома
- а) высокодифференцированная
- б) умеренно-дифференцированная
- в) малодифференцированная
- г) бронхоальвеолярная
- а) гигантоклеточный
- б) светлоклеточный
V. Смешанный рак
- плоскоклеточный и аденокарцинома
- аденокарцинома и мелкоклеточный и т. д.
Гистологическая характеристика рака лёгкого достаточно условна, поскольку клиническое течение может сильно различаться даже для опухолей с одинаковой структурой. Медленнее всего растёт дифференцированный плоскоклеточный рак; для недифференцированного рака характерно быстрое течение с обширным метастазированием. Мелкоклеточный рак лёгкого принадлежит к числу самых злокачественных опухолей. Он отличается коротким анамнезом, скрытым и быстрым протеканием, ранним метастазированием, плохим прогнозом.
Метастазирование
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Рак лёгкого метастазирует тремя путями: лимфогенным, гематогенным и имплантационным.
Наиболее характерен первый путь — в расположенные рядом пульмональные, бронхопульмональные, бифуркационные, трахеобронхиальные, паратрахеальные, околопищеводные (параэзофагеальные) лимфатические узлы. На первом этапе лимфогенного метастазирования поражаются лёгочные лимфатические узлы у места деления долевого бронха на сегментарные. Далее процесс распространяется на бронхопульмональные лимфоузлы вдоль долевых бронхов. На третьем этапе метастазы возникают в корневых лимфоузлах вдоль главного бронха и сосудов корня лёгкого, верхних и нижних трахеобронхиальных лимфоузлах и лимфоузлах у нижней стенки непарной вены. На четвёртом этапе в процесс вовлекаются паратрахеальные, ретрокавальные, предаортокаротидные, перикардиальные, параэзофагеальные лимфоузлы. На пятом — над/подключичные лимфатические узлы.
Гематогенное метастазирование присоединяется при прорастании опухолью кровеносных сосудов — в печень, лёгкие, почки, кость, головной мозг и надпочечники.
При прорастании плевры возможен перенос опухолевых клеток по плевре.
Клиническая картина
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Клинические проявления рака лёгкого существенно зависят от локализации первичного опухолевого узла.
Центральный рак лёгкого. Опухоль, происходящая из слизистой оболочки крупного бронха, проявляет себя довольно рано. При своём росте она раздражает слизистую оболочку бронха, вызывает нарушение бронхиальной проходимости и вентиляции сегмента, доли или всего лёгкого в виде гиповентиляции и ателектаза. В дальнейшем прорастая нервные стволы и плевру, опухоль вызывает болевой синдром и нарушение иннервации соответствующего нерва (диафрагмального, возвратного или блуждающего), а также картину вовлечения плевры в опухолевый процесс. Присоединяющееся метастазирование приводит к появлению вторичных симптомов со стороны поражённых органов и систем.
Когда опухоль прорастает в бронх, появляется кашель, вначале сухой, затем со светлой мокротой, иногда с примесью крови. Возникает гиповентиляция сегмента лёгкого и затем его ателектаз. Мокрота становится гнойной, что сопровождается повышением температуры тела, общим недомоганием, одышкой. Присоединяется раковая пневмония, которая сравнительно легко излечивается, но часто рецидивирует. К раковой пневмонии может присоединиться раковый плеврит, сопровождающийся болевым синдромом.
Если опухоль прорастает возвратный нерв, присоединяется осиплость ввиду паралича голосовых мышц. Поражение диафрагмального нерва вызывает паралич диафрагмы. Прорастание перикарда проявляется болями в области сердца.
Поражение опухолью или её метастазами верхней полой вены вызывает нарушение оттока крови и лимфы из верхней половины туловища, верхних конечностей, головы и шеи. Лицо больного становится одутловатым, с цианотичным оттенком, набухают вены на шее, руках, грудной клетке.
Периферический рак лёгкого. Периферическая опухоль в начальной стадии протекает бессимптомно ввиду отсутствия болевых окончаний в лёгочной ткани. В дальнейшем опухолевый узел увеличивается, прорастает бронхи, плевру и соседние органы; впоследствии в центре опухоли могут возникнуть распад и кровотечение.
При раке лёгкого могут наблюдаться следующие местные симптомы: кашель, выделение крови с мокротой, осиплость голоса, синдром сдавливания опухолью верхней полой вены и смещения средостения, симптомы прорастания опухолью соседних органов. Особенно характерной клинической картиной, в связи с локализацией, проявляется рак верхушки лёгкого с синдромом Панкоста.
При раковом плеврите присоединяется синдром сдавливания лёгкого экссудатом.
К общим симптомам относятся общее ухудшение состояния организма, характерное для развития злокачественных опухолей: интоксикация, одышка, слабость, потеря веса, повышение температуры тела. Для рака лёгкого добавляются также нарушение обмена кальция, дерматит и деформация пальцев по типу «барабанных палочек».
В запущенных стадиях присоединяются симптомы метастатического поражения жизненно важных органов, а также присоединяющиеся к опухолевому росту процессы распада опухоли и лёгочной ткани, бронхиальной непроходимости, ателектазы, тяжёлые лёгочные кровотечения.
Диагностика
правитьКлиническое обследование
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
При клиническом обследовании определяют внешнюю симптоматику развития рака лёгкого:
- Первичные ранние симптомы (кашель, кровохарканье, одышка и боль в груди)
- Вторичные, более поздние симптомы, обусловленные осложнениями при развитии опухоли (воспалительные процессы, прорастание соседних органов, метастазы)
- Общие симптомы, характерные для влияния злокачественных опухолей на организм (общая слабость, утомляемость, снижение работоспособности и т. д.)
Рентгенологическая диагностика
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Рентгенологическое исследование является одним из основных методов диагностики опухолей лёгкого и позволяет своевременно обнаружить его у 80 % больных. В качестве скринингового метода используется флюорография, которая обычно проводится во время профилактических медосмотров. При выявлении изменений (солитарный лёгочный узел, ателектаз и т. д.) на флюорограмме или при наличии клинических показаний применяют рентгенографию в двух проекциях и компьютерную томографию. Кроме того, компьютерная томография является наиболее информативным методом диагностики метастазов в других органах.
Бронхоскопия
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Бронхоскопия позволяет визуально исследовать трахею, главные, долевые, сегментарные, субсегментарные бронхи и, в некоторых случаях, бронхи 6-го, 7-го и более порядков. При этом можно непосредственно увидеть опухоль и осуществить её биопсию. Бронхоскопия считается обязательной при подозрении на рак лёгкого.
Трансторакальная биопсия
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Трансторакальная пункционная биопсия применяется при невозможности проведения других методов (бронхоскопия, катетеризация бронхов, анализ мокроты). Показаниями к её проведению являются:
- округлое образование в любой зоне лёгкого
- подозрение на метастаз в лёгком опухоли с другой локализацией
- множественные внутрилёгочные шаровидные тени
При трансторакальной пункции проводят прокол грудной клетки, отбирают пробу непосредственно из опухоли и исследуют клетки под микроскопом. Такой метод диагностики позволяет подтвердить диагноз у значительного числа больных (62-87 % случаев в зависимости от локализации опухоли). Наиболее частым осложнением (до 50 %) данной процедуры является закрытый пневмоторакс, требующий дренирования плевральной полости.
Ультразвуковая диагностика
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Ультразвуковое исследование является эффективным методом выявления врастания злокачественной опухоли в структуры стенки, масштабного затемнения лёгочной ткани (из-за её уплотнения, плеврального выпота и др.), а через ткань безвоздушного лёгкого получается увидеть непосредственно опухолевый узел.
Такая диагностика является безопасной, простой и сравнительно недорогой. Она позволяет определить опухолевое поражение органов средостения: верхней полой вены, перикарда и камер сердца, правой и левой лёгочных артерий, лёгочных вен, аорты, пищевода, левого предсердия, а также степень применимости хирургического лечения опухоли.
Лабораторные исследования биопсии
правитьОпределение типа опухоли и стратегии лечения
правитьЧтобы разобраться в том, как мутации влияют на терапию рака лёгкого, важно учитывать как врачи классифицируют эту болезнь. Рак лёгкого обычно делят на две основные группы: мелкоклеточный (МРЛ) и немелкоклеточный (НМРЛ). На долю второй приходится от 85 до 90 % от всех случаев[34], к ней относят и следующие типы опухолей[35]:
- аденокарцинома — развивается из клеток железистого эпителия, например, образующ��х слизистую оболочку в дыхательных путях;
- плоскоклеточный рак — начинается в плоских клетках, покрывающих поверхность дыхательных путей, обычно его обнаруживают в центре лёгкого рядом с бронхами;
- крупноклеточная карцинома — может возникать в любой части лёгкого, распространяется и растёт быстрее других типов, под микроскопом её раковые клетки кажутся большими и круглыми[35].
Мелкоклеточный рак, который находят у порядка 10—15 % пациентов, начинается в нейроэндокринных клетках лёгкого, которые вырабатывают гормоны, контролирующие поток воздуха и крови в лёгких. МРЛ и НМРЛ образуют не 100 %, помимо них крайне редко встречаются карциноидные опухоли, саркома или лимфома лёгких[35].
Обычно для любого вида рака лёгкого на I—III стадии заболевания используют хирургию, химиотерапию и лучевую терапию, а также иммунотерапию, которая также может быть частью стратегии лечения некоторых пациентов с неоперабельной III стадией НМРЛ[36].
При запущенном заболевании, в том числе с метастазами (IV стадия), или при рецидиве после лечения используют системную терапию, которая борется со злокачественными клетками во всем теле (в отличие от точечного хирургического вмешательства). В случае мелкоклеточного рака легкого это может быть химиотерапия, либо химиоиммунотерапия. Системная терапия для НМРЛ может включать иммунотерапию и таргетные препараты[37].
В процессе исследований биологии и генетики немелкоклеточного рака легкого, учёные поняли, что это заболевание требует разных подходов к лечению в зависимости от характеристик опухоли[38]. Были найдены драйверные мутации — изменения в последовательности ДНК, которые заставляют обычные клетки мутировать в раковые, расти и распространяться по организму[39]. По данным французского исследования 2016 года в журнале The Lancet, такие генетические изменения обнаруживают примерно в 50 % случаев всех опухолей рака лёгкого, а непосредственно на аденокарциному приходится 64 % из них. Это открытие запустило разработку таргетной терапии — препаратов, нацеленных на конкретные генные мутации. В дальнейшем это привело внедрению персональной терапии — на подобранные индивидуально лекарства опухоль отвечает лучше, чем на стандартную химиотерапию[40][41].
Самые важные и часто встречающиеся в клинической практике драйверные мутации — мутация EGFR (рецептор эпидермального фактора роста) и транслокация ALK (киназа анапластической лимфомы), помимо них существуют и более редкие причины развития опухоли при местно-распространённом и метастатическом НМРЛ (включая III стадию). Мутации выявляются при помощи развёрнутого молекулярно-генетического тестирования, после чего возможно назначить индивидуальную таргетную терапию[42]. В России для прогноза и выбора тактики лечения Минздрав РФ в клинических рекомендациях «Злокачественное новообразование бронхов и легкого» от 2021 года советует врачам проводить исследования на мутации в генах EGFR, BRAF V600E, ALK и ROS1[43].
Молекулярное тестирование
правитьНаличие драйверных мутаций чаще приводит к тому, что рак возникает в более молодом возрасте, а также развивается у некурящих пациентов[44][45].
Мутация гена EGFR
правитьТакая драйверная мутация наблюдается примерно в 20 % случаев аденокарцином немелкоклеточного рака легкого в России[46]. Чаще встречаются у некурящих пациентов, а также у женщин. А в азиатских популяциях частота мутаций EGFR значительно выше и может достигать 62 %[47].
EGFR — это рецептор эпидермального фактора роста. Нарушение в его генах запускает выработку особого белка на клетках, который помогает им расти. Мутацию можно выявить по образцу плазмы крови, гистологическому или цитологическому материалу. Так, американское агентство Министерства здравоохранения Food and Drug Administration (FDA) одобрило тесты ctDNA (жидкая биопсия, тест не зарегистрирован в России) для выявления пациентов с положительной мутацией EGFR. Кроме него могут использоваться другие тесты: аллель-специфическая ПЦР, анализирующая ДНК на наличие аномалий и секвенирование нового поколения (next generation sequencing, NGS)[48].
Препараты с ингибиторами тирозинкиназы EGFR, которые блокируют рецептор эпидермального фактора роста, значительно улучшают результат терапии у пациентов с распространенным НМРЛ. К первому поколению препаратов относятся эрлотиниб и гефитиниб, ко второму — афатиниб. Новые исследования показывают лучшие результаты при лечении препаратом третьего поколения — осимертинибом[англ.], поэтому это лекарство сейчас одобрено FDA в качестве первой линии терапии. Но ингибиторы тирозинкиназы первого и второго остаются приемлемой альтернативой[49].
Транслокация гена ALK
правитьОбследование на транслокацию гена ALK рекомендовано для всех пациентов с аденокарциномой легкого. Эта мутация встречается в 5—7 % случаев НМРЛ[50][51]. При этом средний возраст начала болезни в этом случае — 52 года, а это меньше, чем при НМРЛ без драйверных мутаций. Кроме молодого возраста, таких пациентов отличает то, что они мало курили или не курили вообще[52].
Киназа анапластической лимфомы (ALK, Anaplastic Lymphoma Kinase) активно экспрессируется в период эмбрионального периода, регулируя рост и развитие нервных клеток. Для его работы нужно, чтобы он связался с лигандом-фактором роста (медкином или плейотрофином). Это запускает каскад внутриклеточных реакций, которые приводят к делению и дифференцировке клетки. Такая работа «отключается» ещё до рождения ребёнка, но во взрослом возрасте возможна патологическая активация гена ALK. Он изначально является протонкогеном, так как обладает онкологическим потенциалом, а мутация превращает его в онкоген. Чаще всего к активации ALK приводит хромосомная перестройка (транслокация) в коротком плече 2-й хромосомы, при которой изменяется расположение участков ДНК. Изменивший своё расположение в ДНК и теперь соседствующий с геном ALK участок (чаще всего им является EML4) запускает экспрессию данного гена с последующим образованием патологического рецептора ALK у взрослого человека. Такой мутантный рецептор не нуждается в связывании с лигандом для активации, из-за этого постоянно работает и запускает процессы неконтролируемого размножения клетки, приводя к развитию онкологического заболевания[53].
Транслокация гена ALK определяется по образцам опухоли или плазмы крови с помощью следующих вариантов тестирования[50][54]:
- флюоресцентная гибридизация in situ (FISH) — самый ранний клинический тест, который стал применяться для прямого определения транслокаций с участием гена ALK;
- секвенирование нового поколения (next generation sequencing, NGS) — позволяет одновременно оценивать несколько биомаркеров опухоли, наиболее предпочтительный метод диагностики у американских онкологов;
- иммуногистохимия (IHC, ИГХ) — наиболее популярный метод, который позволяет выявить высокую экспрессию патологического рецептора в цитоплазме опухолевых клеток, FDA одобрил для этого тест Ventana ALK (D5F3) CDx;
- метод полимеразной цепной реакции с обратной транскрипцией (ОТ-ПЦР) — обладает высокой чувствительностью, позволяет работать с образцами, которые содержат низкое количество опухолевых клеток, но очень требователен к качеству РНК, выделенной из образца[50][54].
Рак лёгкого с транслокацией гена ALK чувствителен к ингибиторам тирозинкиназы (ИТК) ALK, на основе чего создают таргетные препараты, помогающие бороться с опухолью на поздних стадиях рака лёгкого[55]. К таким лекарствам относятся алектиниб (рекомендован FDA и EMA в качестве первой линии терапии, зарегистрирован в РФ), кризотиниб[англ.] (самый первый препарат, используемый в клинической практике), церитиниб, а также бригатиниб и лорлатиниб[50]. Бригатиниб на 2021 год не имеет регистрации на территории России[56], лорлатиниб зарегистрирован в июле 2021 года — это ингибитор тирозинкиназы ALK 3-го поколения. Препарат, который одобрен для применения после терапии ИТК 2-го поколения (алектиниба или церитиниба) или несколькими ИТК ALK[57].
Частым осложнением при раке лёгкого являются метастазы в головной мозг — это порядка 16—20 % от всех случаев заболевания, а при ALK-положительном НМРЛ риск получить метастазы в центральной нервной системе в течение болезни повышается до 50—60 %. В борьбе с метастазированием в головной мозг эффективна терапия алектинибом[58].
Транслокация гена ROS1
правитьДанная мутация обычно выявляется у молодых некурящих людей с аденокарциномой, чаще всего не спровоцированной мутациями ALK и EGFR[59]. Транслокация ROS1 возникает при слиянии гена ROS1[англ.] с другим геном, чаще — с CD74, что вызывает неконтролируемый рост опухолевых клеток. Перестройку в гене ROS1 имеет приблизительно 1—2 % людей с немелкоклеточным раком легкого. Такую драйверную мутацию можно обнаружить с помощью методов FISH и NGS[48].
Пациенты с транслокацией ROS1 также чувствительны к ингибитору тирозинкиназы ROS1 — препараты энтректиниб и кризотиниб. Оба одобрены FDA для пациентов с транслокацией ROS1 как препараты первой линии и после химиотерапии[60].
Транслокация гена RET
правитьТранслокация гена RET[англ.] возникает из-за слияния частей ДНК с другим геном, что приводит к неконтролируемому росту, делению клеток и развитию рака. Такую мутацию находят в 1—2 % случаев аденокарцином у молодых или некурящих пациентов. Драйверную мутацию можно диагностировать с помощью методов FISH или NGS. FDA одобрил для лечения взрослых пациентов с распространённым RET-положительным НМРЛ препараты пралсетиниб, селперкатиниб[англ.][61][62]. Для терапии RET при НМРЛ также исследовались другие препараты: кабозантиниб, сунитиниб, вандетаниб или алектиниб[48].
Мутация гена BRAF
правитьBRAF (серин/треониновая протеинкиназа) — это название гена и белка. Белок BRAF помогает контролировать рост клеток, а мутация в гене BRAF приводит к созданию «аномального» белка, который безостановочно посылает сигналы клетке и приводит к неконтролируемому клеточному росту. Эта мутация встречается примерно в 1—3 % случаев немелкоклеточного рака легкого, обычно у заядлых курильщиков[63]. При поиске драйверной мутации проверяют её определённый вид — BRAF V600E. Обнаружить его можно методом ПЦР или NGS. В качестве терапии FDA одобрило комбинацию дабрафениба и траметиниба[48].
Мутация гена HER2
правитьHER2 (рецептор эпидермального фактора роста 2 типа) — это сигнальный рецептор в клетке, помогает ей получать определённые «сообщения» от других клеток. Мутация гена нарушает связь и также вызывает неконтролируемое развитие опухоли. Эта поломка встречается примерно в 1—3 % случаев немелкоклеточного рака лёгкого и преимущественно приводит к образованию аденокарциномы. Такое чаще встречаются среди некурящих, а большинство пациентов — женщины. Рак легкого с мутацией HER2 иногда хорошо отзывается на HER2-таргетные препараты, особенно, трастузумаб. В исследованиях опухоль положительно реагировала на лекарство в 44—62 % случаев[48][63].
Мутация гена MET
правитьУ гена MET[англ.] есть два критичных для подбора терапии изменения: амплификация (наращивание дополнительных копий) и пропуск 14 экзона (неправильное сращивание). MET является рецептором роста, поэтому наличие дополнительных копий приводят к усилению сигналов, посылаемых раковым клеткам. Амплификация гена MET выявляется у 2—4 % пациентов с НМРЛ, не проходивших лечение. В 5—20 % случаев опухолей, вызванных мутацией EGFR, амплификация MET является причиной резистентности к препаратам-ингибиторам EGFR[48].
Пропуск 14 экзона в гене MET встречается в 3 % случаев аденокарцином лёгких и является причиной развития относительно редких видов НМРЛ, связанных со саркомами (до 20 % случаев). Мутация, которая вызывает пропуск 14 экзона, препятствует нормальному развитию клетки: когда белок MET больше не нужен, его расщепляет и «выбрасывает» из клетки другой белок, если же механизм сломан, то MET задерживается в клетке и посылает слишком много сигналов роста, которые могут способствовать развитию рака.
Мутации с «пропуском» экзона-14 чаще всего обнаруживают с помощью ПЦР или NGS[64], а амплификацию MET может найти анализ FISH или также NGS-тест. При мутации с «пропуском» экзона-14 пациентам предлагается терапия капматинибом или тепотинибом[48].
Слияние гена NTRK
правитьЕсли в опухоли происходит слияние генов NTRK с другими генами — это может вызывать активацию гена NTRK. Благодаря этому происходит неконтролируемый рост клеток, что приводит к раку. При раке лёгкого такие слияния встречается редко — менее 1 % случаев, однако для таких генетических изменений существует эффективное лечение[65]. Слияние NTRK можно обнаружить с помощью секвенирования следующего поколения (NGS). А в качестве таргетного метода лечения рака лёгкого при слиянии генов NTRK используют энтректиниб и ларотректиниб (оба препарата на 2021 год не зарегистрированы в РФ)[66].
Тестирование на PD-L1
правитьКогда результаты о наличии мутаций EGFR и ALK отрицательные и у пациентов не удаётся определить драйверную мутацию и подобрать таргетную или индивидуальную терапию, то врачу следует проверить экспрессию белка PD-L1 (лиганд программируемой клеточной гибели), который присутствует в опухоли, и назначить иммунотерапию по её результату[34][67][68]. Экспрессию PD-L1 определяют иммуногистохимическим методом. Для тестирования может быть использован операционный или биопсийный материал первичной или метастатической опухоли, фиксированный в формалине и залитый в парафин[43].
Лечение
правитьХирургическое лечение
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Хирургическое вмешательство подразделяется на:
- радикальное
- условно-радикальное
- паллиативное
При радикальной операции удалению подвергается весь опухолевый комплекс: первичный очаг, регионарные лимфатические узлы, клетчатка с путями метастазирования. Наиболее часто проводятся операции в объёме лобэктомии (удаление одной доли лёгкого), билобэктомии только для правого лёгкого (резекция двух долей лёгкого), пульмонэктомии — удаление лёгкого целиком. Расширенные и комбинированные пульмонэктомии — полное удаление лёгкого с резекцией лимфатических узлов разных групп и удалением соседних органов, проросших опухолью, соответственно. На 1-й и 2-й стадиях выполняются лобэктомия. На стадии 3А обычно выполняют пульмонэктомию. К условно-радикальной операции добавляют лучевую и лекарственную терапию. Следует учитывать также и то, что часть первичной опухолевой ткани и метастазы иногда не могут быть хирургически удалены ввиду угрозы кровотечения или процессов распада в ателектазе.
Противопоказаниями к радикальной операции являются:
- нерезектабельность — распространение опухоли на соседние ткани и органы, при котором технически невозможно радикально удалить опухоль.
- нецелесообразность ввиду наличия отдалённых метастазов.
- недостаточность функций сердечно-сосудистой и дыхательной систем
- декомпенсированные заболевания внутренних органов
Хирургическому удалению опухоли часто сопутствует широкое удаление корневых, трахеобронхиальных лимфоузлов, клетчатки и лимфоузлов средостения, резекция грудной стенки, перикарда, диафрагмы, бифуркации трахеи, предсердия, магистральных сосудов (аорты, верхней полой вены), мышечной стенки пищевода и других тканей, проросших опухолью.
Лучевая терапия
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Лучевое лечение рака лёгкого проводится в послеоперационный период на ложе опухоли и пути регионального лимфотока. При неоперабельных формах рака, в случае отказа больного от оперативного лечения или при наличии серьёзных противопоказаний к оперативному вмешательству лучевая терапия может проводиться как самостоятельный метод лечения.
Лучевая терапия применяется как для радикального, так и паллиативного лечения. При радикальном лучевом лечении облучению подвергают как саму опухоль, так и зоны регионального метастазирования, то есть корень лёгкого, средостение, зоны регионального лимфотока общей дозой 50—70 Гр.
В последнее время возможности лучевой терапии расширились с использованием стереотаксической лучевой терапии тела с синхронизацией с дыханием пациента. Такими возможностями обладают некоторые современные медицинские ускорители и Кибер-нож. При таком подходе достигаемая точность облучения составляет порядка одного-трёх миллиметров, что позволяет подводить на очаг абляционные дозы излучения, но не требует хирургического доступа и анестезии. Этот метод облучения наиболее востребован при единичных метастазах в лёгкое и при неоперабельном первичном раке лёгкого.
Химиотерапия
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
При немелкоклеточном раке лёгкого химиотерапия проводится при наличии противопоказаний к хирургическому и лучевому лечению. При этом назначаются следующие препараты: доксорубицин, цисплатин, винкристин, этопозид, циклофосфамид, метотрексат, блеомицин, нитрозомочевина, винорелбин, паклитаксел, доцетаксел, гемцитабин, карбоплатин, винорельбин, иринотекан и др., применяемые курсами с интервалами в 3-4 недели (до 6-7 курсов).
При мелкоклеточном раке лёгкого химиотерапия в составе комплекса с лучевой терапией является наиболее эффективным лечением. Препараты те же, что и при немелкоклеточном раке лёгкого.
Противопоказание к химиотерапии РЛ: тяжелое состояние пациента.
Частичное уменьшение размеров первичной опухоли и метастазов наблюдается не у всех больных, полное исчезновение злокачественного новообразования происходит редко. Химиотерапия при отдалённых метастазах не приводит к излечению (паллиативная химиотерапия), она только снижает тяжесть проявлений заболевания, и незначительно увеличивает продолжительность жизни.
К методам лечения рака лёгкого также относятся[источник не указан 2980 дней]:
- Фотодинамическая терапия
- Химиоэмболизация
- Радиоэмболизация
- Брахитерапия
- Криодеструкция
- Лазерная коагуляция
- Радиочастотная абляция
- Биотерапия
- Иммунотерапия
Таргетная терапия
правитьПрепараты
правитьадаграсиб[англ.], мобоцертиниб[англ.], репотректиниб[англ.], лазертиниб[англ.].
Моноклональные антитела
правитьПембролизумаб — иммуноонкологический препарат, является моноклональным антителом, блокирующим взаимодействие рецепторов PD-1 на Т-лимфоцитах иммунной системы и лигандов PD-L1 и PD-L2 на опухолевой клетке. Таким образом препарат реактивирует способность иммунной системы организма бороться со злокачественным новообразованием.[69] Пембролизумаб включен в утвержденный правительством перечень необходимых и важнейших лекарственных препаратов (ЖНВЛП) на 2018 год. Препарат разработан компанией MSD и впервые зарегистрирован в России в ноябре 2016 года. В настоящее время он одобрен к применению на территории страны по трем показаниям: для лечения взрослых пациентов с неоперабельной или метастатической меланомой, в качестве первой линии терапии метастатического немелкоклеточного рака легкого (НМРЛ) с высоким уровнем экспрессии PD-L1 (≥50 %), а также больных с метастатическим НМРЛ, у которых подтверждена экспрессия PD-L1 опухолевыми клетками и наблюдается прогрессирование заболевания во время или после терапии препаратами платины.[70] Монотерапия пембролизумабом продлевает общую выживаемость у ранее нелеченых пациентов с немелкоклеточным раком легкого, по сравнению с химиотерапией.[71][72]
Согласно результатам исследования IMpower132 III фазы, добавление атезолизумаба к терапии первой линии пеметрекседом и химиотерапевтическими препаратами, снижает риск прогрессирования заболевания или смерти у пациентов с неплоскоклеточным НМРЛ. Снижение риска прогрессирования заболевания составило примерно 40 %. Также наблюдалось улучшение общей выживаемости на 4,5 месяца, однако статистическая значимость пока не была достигнута. IMpower132 является открытым рандомизированным исследованием, в котором проводится оценка эффективности и безопасности атезолизумаба комбинации с химиотерапией (цисплатин или карбоплатин и пеметрексед) в сравнении с химиотерапией без атезолизумаба у пациентов с НМРЛ, ранее не получавших химиотерапию. В исследование включено 568 человек.[73]
В 2018 году Администрацией по контролю за продуктами и лекарствами США (FDA) был одобрен препарат (дурвалумаб[англ.]) для снижения риска прогрессирования рака у пациентов с неоперабельным немелкоклеточным раком легкого (НМРЛ) третьей стадии, чье заболевание прогрессирует после химиотерапии и радиотерапии. Дурвалумаб способен подавлять лиганд-1 программируемой гибели (PDL1) и стимулировать работу иммунной системы. Ранее он был зарегистрирован FDA для применения среди больных раком мочевого пузыря. Согласно результатам клинического исследования PACIFIC, прошедшего при участии 173 пациентов, дурвалумаб в сравнении с плацебо увеличил показатель выживаемости без прогрессирования до 16,8 месяца (в плацебо-группе этот показатель составил 5,6 месяцев). Частота объективного ответа при применении дурвалумаба и плацебо составила 28,4 % и 16,0 % соответственно.[74]
Другие моноклональные антитела: ипилимумаб, ниволумаб, рамуцирумаб, нецитумумаб, амивантамаб. Проходят клинические испытания: датопотамаб дерукстекан[англ.], патритумаб дерукстекан[англ.], тарлатамаб[англ.], сугемалимаб[англ.].
Паллиативное лечение
правитьВ разделе не хватает ссылок на источники (см. рекомендации по поиску). |
Паллиативное лечение рака лёгкого применяется в том случае, когда возможности противоопухолевого лечения ограничены или исчерпаны. Такое лечение направлено на улучшение качества жизни (уменьшение выраженности симптомов) и увеличение продолжительности жизни неизлечимых больных и включает в себя:
- обезболивание
- кислородотерапию
- симптоматическую терапию
- психологическую помощь
- переливание крови
- борьба с анемией
- детоксикацию
- паллиативную лучевую терапию
- паллиативную химиотерапию
- паллиативное хирургическое вмешательство (трахеостомия, гастростомия, энтеростомия, нефростомия и т. д.)
Паллиативная помощь при раке лёгкого применяется для борьбы с одышкой, кашлем, кровохарканьем, болевыми ощущениями. Проводится лечение присоединяющихся к опухолевому процессу пневмонии и пневмонита, возникающих при лучевой и химиотерапии.
Методы паллиативного лечения во многом индивидуальны и зависят от состояния больного.
Прогноз
правитьВ случае нелеченого рака лёгкого умирают 87 % больных в течение 2 лет с момента установления диагноза. При использовании хирургического метода можно достичь 30%-й выживаемости больных в течение 5 лет.[источник не указан 3910 дней] Раннее обнаружение опухоли позволяет повысить шансы на излечение: на стадии T1N0M0 она достигает 80 %. Совместное проведение хирургического, лучевого и медикаментозного лечения позволяет поднять 5-летнюю выживаемость ещё на 40 %.[источник не указан 3910 дней] Наличие метастазов значительно ухудшает прогноз. В 2020 году летальность во всем мире составила 81,39 % (на 2 206 771 случай 1 796 144 смерти)[75].
Примечания
править- ↑ 1 2 3 4 Disease Ontology (англ.) — 2016.
- ↑ 1 2 В.А. Нидюлин Б.В. Эрдниева. Об эпидемиологии рака лёгких // Медицинский вестник Башкортостана : обзорная статья. — Башкирский государственный медицинский университет, 2009. — Т. 4, № 1. — С. 66—71. — ISSN 1999-6209. Архивировано 30 мая 2019 года.
- ↑ Vaporciyan, AA; Nesbitt J. C., Lee JS et al. Cancer Medicine. — B C Decker, 2000. — С. 1227—1292. — ISBN 1-55009-113-1.
- ↑ Biesalski, HK; Bueno de Mesquita B., Chesson A et al. European Consensus Statement on Lung Cancer: risk factors and prevention. Lung Cancer Panel (англ.) // CA: A Cancer Journal for Clinicians[англ.] : journal. — Smoking is the major risk factor, accounting for about 90% of lung cancer incidence., 1998. — Vol. 48, no. 3. — P. 167—176; discussion 164—166. — doi:10.3322/canjclin.48.3.167. — PMID 9594919. (недоступная ссылка)
- ↑ Этиология рака лёгких. (недоступная ссылка) Пер. с англ. Н. Д. Фирсова (2017)
- ↑ Hecht, S. Tobacco carcinogens, their biomarkers and tobacco-induced cancer (англ.) // Nature Reviews Cancer : journal. — Nature Publishing Group, 2003. — October (vol. 3, no. 10). — P. 733—744. — doi:10.1038/nrc1190. — PMID 14570033. Архивировано 29 сентября 2009 года.
- ↑ Sopori, M. Effects of cigarette smoke on the immune system (англ.) // Nature Reviews Immunology. — Nature Publishing Group, 2002. — May (vol. 2, no. 5). — P. 372—377. — doi:10.1038/nri803. — PMID 12033743.
- ↑ Peto, R; Lopez A. D., Boreham J et al. Mortality from smoking in developed countries 1950–2000: Indirect estimates from National Vital Statistics (англ.). — Oxford University Press, 2006. — ISBN 0-19-262535-7. Архивировано 5 сентября 2007 года.
- ↑ Villeneuve, PJ; Mao Y. Lifetime probability of developing lung cancer, by smoking status, Canada (англ.) // Canadian Journal of Public Health[англ.] : journal. — 1994. — November (vol. 85, no. 6). — P. 385—388. — PMID 7895211.
- ↑ Chlebowski RT et al. Non-small cell lung cancer and estrogen plus progestin use in postmenopausal women in the Women’s Health Initiative randomized clinical trial (англ.) // Journal of Clinical Oncology[англ.] : journal. — 2009. — Vol. 27, no. 155. — P. CRA1500.
- ↑ US Department of Health and Human Services. The Health Benefits of Smoking Cessation: a Report of the Surgeon General (PDF) vi, 130, 148, 152, 155, 164, 166. Centers for Disease Control (CDC), Office on Smoking and Health. (30 сентября 1990). Дата обращения: 18 ноября 2007. Архивировано 26 ноября 2007 года.
- ↑ Nordquist, LT; Simon G.R., Cantor A et al. Improved survival in never-smokers vs current smokers with primary adenocarcinoma of the lung (англ.) // Chest : journal. — American College of Chest Physicians, 2004. — August (vol. 126, no. 2). — P. 347—351. — doi:10.1378/chest.126.2.347. — PMID 15302716. Архивировано 6 декабря 2008 года.
- ↑ Tammemagi, CM; Neslund-Dudas C., Simoff M., Kvale P. Smoking and lung cancer survival: the role of comorbidity and treatment (англ.) // Chest : journal. — American College of Chest Physicians, 2004. — January (vol. 125, no. 1). — P. 27—37. — doi:10.1378/chest.125.1.27. — PMID 14718417. Архивировано 6 декабря 2008 года.
- ↑ Centers for Disease Control (CDC). 1986 Surgeon General's report: the health consequences of involuntary smoking (англ.) // Morbidity and Mortality Weekly Report : journal. — Centers for Disease Control and Prevention, 1986. — December (vol. 35, no. 50). — P. 769—770. — PMID 3097495. Архивировано 21 ноября 2011 года.
* National Research Council. Environmental tobacco smoke: measuring exposures and assessing health effects (англ.). — National Academy Press[англ.], 1986. — ISBN 0-309-07456-8. Архивировано 11 мая 2011 года.
* EPA. Respiratory health effects of passive smoking: lung cancer and other disorders (англ.) : journal. — EPA, 1992. Архивировано 30 июня 2010 года.
* California Environmental Protection Agency. Health effects of exposure to environmental tobacco smoke (англ.) // Tobacco Control : journal. — 1997. — Vol. 6, no. 4. — P. 346—353. — doi:10.1136/tc.6.4.346. — PMID 9583639. — PMC 1759599. Архивировано 8 августа 2007 года.
* CDC; Centers for Disease Control and Prevention (CDC). State-specific prevalence of current cigarette smoking among adults, and policies and attitudes about secondhand smoke—United States, 2000 (англ.) // Morbidity and Mortality Weekly Report : journal. — Atlanta, Georgia: CDC, 2001. — December (vol. 50, no. 49). — P. 1101—1106. — PMID 11794619. Архивировано 25 июня 2017 года.
* Alberg, AJ; Samet J.M. Epidemiology of lung cancer // Chest. — American College of Chest Physicians, 2003. — Январь (т. 123, № S1). — С. 21S—49S. — doi:10.1378/chest.123.1_suppl.21S. — PMID 12527563. Архивировано 9 мая 2008 года. - ↑ Boffetta, P; Agudo A., Ahrens W et al. Multicenter case-control study of exposure to environmental tobacco smoke and lung cancer in Europe (англ.) // Journal of the National Cancer Institute[англ.] : journal. — Oxford University Press, 1998. — October (vol. 90, no. 19). — P. 1440—1450. — doi:10.1093/jnci/90.19.1440. — PMID 9776409. Архивировано 25 ноября 2009 года.
- ↑ Report of the Scientific Committee on Tobacco and Health. Department of Health (March 1998). Дата обращения: 9 июля 2007. Архивировано 17 апреля 2012 года.
* Hackshaw, A.K. Lung cancer and passive smoking // Statistical Methods in Medical Research[англ.]. — 1998. — Июнь (т. 7, № 2). — С. 119—136. — doi:10.1191/096228098675091404. — PMID 9654638. - ↑ National Health and Medical Research Council. The health effects and regulation of passive smoking (англ.) : journal. — Australian Government Publishing Service, 1994. — April. Архивировано 29 сентября 2007 года.
- ↑ Schick, S; Glantz S. Philip Morris toxicological experiments with fresh sidestream smoke: more toxic than mainstream smoke (англ.) // Tobacco Control : journal. — 2005. — December (vol. 14, no. 6). — P. 396—404. — doi:10.1136/tc.2005.011288. — PMID 16319363. — PMC 1748121.
- ↑ Thun, M.J., S.J. Henley, D Burns, et al., Lung cancer death rates in lifelong nonsmokers. J. Natl Cancer Inst, 2006. 98: p.691.
- ↑ Catelinois O., Rogel A., Laurier D., et al. Lung cancer attributable to indoor radon exposure in france: impact of the risk models and uncertainty analysis (англ.) // Environmental Health Perspectives[англ.] : journal. — 2006. — September (vol. 114, no. 9). — P. 1361—1366. — doi:10.1289/ehp.9070. — PMID 16966089. — PMC 1570096. Архивировано 20 января 2009 года.
- ↑ Schmid K., Kuwert T., Drexler H. Radon in indoor spaces: an underestimated risk factor for lung cancer in environmental medicine (англ.) // Dtsch Arztebl Int : journal. — 2010. — March (vol. 107, no. 11). — P. 181—186. — doi:10.3238/arztebl.2010.0181. — PMID 20386676. — PMC 2853156.
- ↑ O'Reilly, KM; Mclaughlin A.M., Beckett W.S., Sime P.J. Asbestos-related lung disease (англ.) // American Family Physician[англ.]. — 2007. — March (vol. 75, no. 5). — P. 683—688. — PMID 17375514. Архивировано 29 сентября 2007 года.
- ↑ Leroux, C; Girard N., Cottin V et al. Jaagsiekte Sheep Retrovirus (JSRV): from virus to lung cancer in sheep // Veterinary Research[англ.]. — Т. 38, № 2. — С. 211—228. — doi:10.1051/vetres:2006060. — PMID 17257570.
- ↑ Palmarini, M; Fan H. Retrovirus-induced ovine pulmonary adenocarcinoma, an animal model for lung cancer (англ.) // Journal of the National Cancer Institute[англ.]. — Oxford University Press, 2001. — November (vol. 93, no. 21). — P. 1603—1614. — doi:10.1093/jnci/93.21.1603. — PMID 11698564. Архивировано 25 сентября 2009 года.
- ↑ Cheng, YW; Chiou H.L., Sheu GT et al. The association of human papillomavirus 16/18 infection with lung cancer among nonsmoking Taiwanese women (англ.) // Cancer Research[англ.] : journal. — American Association for Cancer Research[англ.], 2001. — 1 April (vol. 61, no. 7). — P. 2799—2803. — PMID 11306446. Архивировано 30 апреля 2010 года.
- ↑ Zheng, H; Aziz H.A., Nakanishi Y et al. Oncogenic role of JC virus in lung cancer (англ.) // The Journal of Pathology[англ.]. — 2007. — May (vol. 212, no. 3). — P. 306—315. — doi:10.1002/path.2188. — PMID 17534844.
- ↑ Giuliani, L; Jaxmar T., Casadio C et al. Detection of oncogenic viruses (SV40, BKV, JCV, HCMV, HPV) and p53 codon 72 polymorphism in lung carcinoma (англ.) // Lung Cancer : journal. — 2007. — September (vol. 57, no. 3). — P. 273—281. — doi:10.1016/j.lungcan.2007.02.019. — PMID 17400331.
- ↑ Pope, CA 3rd; Burnett R.T., Thun M.J., Calle E.E., Krewski D., Ito K., Thurston G.D. Lung cancer, cardiopulmonary mortality, and long-term exposure to fine particulate air pollution (англ.) // JAMA : journal. — 2002. — Vol. 287, no. 9. — P. 1132—1141. — doi:10.1001/jama.287.9.1132. — PMID 11879110. Архивировано 20 июня 2010 года.
- ↑ Krewski D., Burnett R., Jerrett M., Pope C.A., Rainham D., Calle E., Thurston G., Thun M. Mortality and long-term exposure to ambient air pollution: ongoing analyses based on the American Cancer Society cohort (англ.) // J Toxicol Environ Health A : journal. — Vol. 68, no. 13—14. — P. 1093—1109. — doi:10.1080/15287390590935941. — PMID 16024490.
- ↑ Valavanidis A., Fiotakis K., Vlachogianni T. Airborne particulate matter and human health: toxicological assessment and importance of size and composition of particles for oxidative damage and carcinogenic mechanisms (англ.) // J Environ Sci Health C Environ Carcinog Ecotoxicol Rev. : journal. — Vol. 26, no. 4. — P. 339—362. — doi:10.1080/10590500802494538. — PMID 19034792.
- ↑ Travis, WD; Travis L.B., Devesa S.S. Lung cancer (англ.) // Cancer[англ.]. — Wiley-Blackwell, 1995. — January (vol. 75, no. Suppl. 1). — P. 191—202. — doi:10.1002/1097-0142(19950101)75:1+<191::AID-CNCR2820751307>3.0.CO;2-Y. — PMID 8000996.
- ↑ Morandi, U; Casali C., Rossi G. Bronchial typical carcinoid tumors // Seminars in Thoracic and Cardiovascular Surgery. — 2006. — Т. 18, № 3. — С. 191—198. — doi:10.1053/j.semtcvs.2006.08.005. — PMID 17185178.
- ↑ Etienne-Mastroianni, B; Falchero L., Chalabreysse L et al. Primary sarcomas of the lung: a clinicopathologic study of 12 cases (англ.) // Lung Cancer : journal. — 2002. — December (vol. 38, no. 3). — P. 283—289. — doi:10.1016/S0169-5002(02)00303-3. — PMID 12445750.
- ↑ 1 2 Rogerio C Lilenbaum. Patient education: Non-small cell lung cancer treatment; stage IV cancer (Beyond the Basics) (англ.). www.uptodate.com (16 апреля 2020). Дата обращения: 2 ноября 2021. Архивировано 9 ноября 2021 года.
- ↑ 1 2 3 Types of lung cancer. www.cancerresearchuk.org. Дата обращения: 2 ноября 2021. Архивировано 9 ноября 2021 года.
- ↑ Non-small Cell Lung Cancer Treatment by Stage (англ.). www.cancer.org. Дата обращения: 2 ноября 2021. Архивировано 2 ноября 2021 года.
- ↑ Lung Cancer Treatment by Stage (англ.). www.cancer.org. Дата обращения: 2 ноября 2021. Архивировано 27 июля 2021 года.
- ↑ Lynette M. Sholl. Biomarkers in lung adenocarcinoma: a decade of progress // Archives of Pathology & Laboratory Medicine. — 2015-04. — Т. 139, вып. 4. — С. 469–480. — ISSN 1543-2165. — doi:10.5858/arpa.2014-0128-RA. Архивировано 16 апреля 2022 года.
- ↑ https://www.cancer.gov/publications/dictionaries/cancer-terms/def/driver-mutation (англ.). www.cancer.gov (2 февраля 2011). Дата обращения: 2 ноября 2021. Архивировано 12 октября 2021 года.
- ↑ Fabrice Barlesi, Julien Mazieres, Jean-Philippe Merlio, Didier Debieuvre, Jean Mosser. Routine molecular profiling of patients with advanced non-small-cell lung cancer: results of a 1-year nationwide programme of the French Cooperative Thoracic Intergroup (IFCT) (англ.) // The Lancet. — 2016-04-02. — Т. 387, вып. 10026. — С. 1415–1426. — ISSN 1474-547X 0140-6736, 1474-547X. — doi:10.1016/S0140-6736(16)00004-0.
- ↑ Mark G. Kris, Bruce E. Johnson, Lynne D. Berry, David J. Kwiatkowski, A. John Iafrate. Using Multiplexed Assays of Oncogenic Drivers in Lung Cancers to Select Targeted Drugs // JAMA. — 2014-05-21. — Т. 311, вып. 19. — С. 1998–2006. — ISSN 0098-7484. — doi:10.1001/jama.2014.3741.
- ↑ David S. Ettinger, Douglas E. Wood, Dara L. Aisner, Wallace Akerley, Jessica R. Bauman. NCCN Guidelines Insights: Non–Small Cell Lung Cancer, Version 2.2021: Featured Updates to the NCCN Guidelines (EN) // Journal of the National Comprehensive Cancer Network. — 2021-03-02. — Т. 19, вып. 3. — С. 254–266. — ISSN 1540-1413 1540-1405, 1540-1413. — doi:10.6004/jnccn.2021.0013. Архивировано 7 ноября 2021 года.
- ↑ 1 2 Рубрикатор КР. cr.minzdrav.gov.ru. Дата обращения: 2 ноября 2021. Архивировано 9 ноября 2021 года.
- ↑ Anna May Suidan, Laila Roisman, Anna Belilovski Rozenblum, Maya Ilouze, Elizabeth Dudnik. Lung Cancer in Young Patients: Higher Rate of Driver Mutations and Brain Involvement, but Better Survival // Journal of Global Oncology. — 2019-12-01. — Вып. 5. — С. 1–8. — doi:10.1200/JGO.18.00216.
- ↑ Lan-Ying Gou, Yi-Long Wu. Prevalence of driver mutations in non-small-cell lung cancers in the People's Republic of China // Lung Cancer (Auckland, N.Z.). — 2014. — Т. 5. — С. 1–9. — ISSN 1179-2728. — doi:10.2147/LCTT.S40817. Архивировано 16 апреля 2022 года.
- ↑ Е.Н. Имянитов. Современные представления о молекулярных мишенях в опухолях лёгкого. — СПб.: НИИ онкологии им. Н.Н. Петрова Минздрава России, 2018. — С. 93—104. Архивировано 21 января 2022 года.
- ↑ David E Midthun. Overview of the initial treatment and prognosis of lung cancer (англ.). www.uptodate.com. Дата обращения: 2 ноября 2021. Архивировано 4 февраля 2022 года.
- ↑ 1 2 3 4 5 6 7 Lecia V Sequist, MPHJoel W Neal. Personalized, genotype-directed therapy for advanced non-small cell lung cancer (англ.). www.uptodate.com. UpToDate (6 октября 2021). Дата обращения: 2 ноября 2021. Архивировано 20 января 2022 года.
- ↑ Rogerio C Lilenbaum. Systemic therapy for advanced non-small cell lung cancer with an activating mutation in the epidermal growth factor receptor (англ.). www.uptodate.com. UpToDate. Дата обращения: 2 ноября 2021. Архивировано 20 января 2022 года.
- ↑ 1 2 3 4 Benjamin Solomon, Christine M Lovly. Anaplastic lymphoma kinase (ALK) fusion oncogene positive non-small cell lung cancer (англ.). www.uptodate.com (7 мая 2021). Дата обращения: 2 ноября 2021. Архивировано 2 ноября 2017 года.
- ↑ ALK-положительный НМРЛ. www.med.roche.ru. Дата обращения: 2 ноября 2021. Архивировано 15 июня 2021 года.
- ↑ Puey Ling Chia, Paul Mitchell, Alexander Dobrovic, Thomas John. Prevalence and natural history of ALK positive non-small-cell lung cancer and the clinical impact of targeted therapy with ALK inhibitors // Clinical Epidemiology. — 2014-11-20. — Т. 6. — С. 423–432. — ISSN 1179-1349. — doi:10.2147/CLEP.S69718. Архивировано 24 января 2022 года.
- ↑ Xue Du, Yun Shao, Hai‐Feng Qin, Yan‐Hong Tai, Hong‐Jun Gao. ALK‐rearrangement in non‐small‐cell lung cancer (NSCLC) // Thoracic Cancer. — 2018-4. — Т. 9, вып. 4. — С. 423–430. — ISSN 1759-7706. — doi:10.1111/1759-7714.12613. Архивировано 16 апреля 2022 года.
- ↑ 1 2 Andrew J. Weickhardt, Dara L. Aisner, Wilbur A. Franklin, Marileila Varella-Garcia, Robert C. Doebele. Diagnostic Assays for Identification of Anaplastic Lymphoma Kinase–Positive Non–Small Cell Lung Cancer // Cancer. — 2013-04-15. — Т. 119, вып. 8. — С. 1467–1477. — ISSN 0008-543X. — doi:10.1002/cncr.27913. Архивировано 16 апреля 2022 года.
- ↑ Non-small Cell Lung Cancer Targeted Drug Therapy (англ.). www.cancer.org. Дата обращения: 2 ноября 2021. Архивировано 2 ноября 2021 года.
- ↑ Государственный реестр лекарственных средств. grls.rosminzdrav.ru. Дата обращения: 2 ноября 2021. Архивировано 16 апреля 2022 года.
- ↑ Pharmedu. pharmedu.ru. Дата обращения: 2 ноября 2021. Архивировано 30 марта 2022 года.
- ↑ Howard (Jack) West, Benjamin Solomon. "Brain metastases in non-small cell lung cancer". uptodate. Архивировано 9 ноября 2021. Дата обращения: 3 ноября 2021.
- ↑ Молекулярно-генетическое тестирование пациентов с немелкоклеточным раком легкого. www.oncology.ru. Дата обращения: 2 ноября 2021. Архивировано 14 марта 2022 года.
- ↑ Nasser H. Hanna, Andrew G. Robinson, Sarah Temin, Sherman Baker, Julie R. Brahmer. Therapy for Stage IV Non-Small-Cell Lung Cancer With Driver Alterations: ASCO and OH (CCO) Joint Guideline Update // Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. — 2021-03-20. — Т. 39, вып. 9. — С. 1040–1091. — ISSN 1527-7755. — doi:10.1200/JCO.20.03570. Архивировано 16 апреля 2022 года.
- ↑ RETEVMOTM (selpercatinib) capsules, for oral use Initial U.S. Approval: 2020 (англ.) (2020). Дата обращения: 3 ноября 2021. Архивировано 13 апреля 2022 года.
- ↑ GAVRETO™ (pralsetinib) capsules, for oral use Initial U.S. Approval: 2020 (англ.) (2020). Дата обращения: 3 ноября 2021. Архивировано 29 октября 2021 года.
- ↑ 1 2 Liza C. Villaruz, Mark A. Socinski, Shira Abberbock, Lynne D. Berry, Bruce E. Johnson. Clinicopathologic features and outcomes of patients with lung adenocarcinomas harboring BRAF mutations in the Lung Cancer Mutation Consortium // Cancer. — 2015-02-01. — Т. 121, вып. 3. — С. 448–456. — ISSN 1097-0142. — doi:10.1002/cncr.29042. Архивировано 21 января 2022 года.
- ↑ David R. Spigel, Thomas J. Ervin, Rodryg A. Ramlau, Davey B. Daniel, Jerome H. Goldschmidt. Randomized phase II trial of Onartuzumab in combination with erlotinib in patients with advanced non-small-cell lung cancer // Journal of Clinical Oncology: Official Journal of the American Society of Clinical Oncology. — 2013-11-10. — Т. 31, вып. 32. — С. 4105–4114. — ISSN 1527-7755. — doi:10.1200/JCO.2012.47.4189. Архивировано 25 мая 2021 года.
- ↑ NCCN. Рак лёгкого метастатический. Немелкоклеточный рак лёгкого. Дата обращения: 3 ноября 2021. Архивировано 17 июня 2021 года.
- ↑ What are the treatment options for NTRK gene fusion positive non–small cell lung cancer (NSCLC)? (англ.). www.medscape.com. Дата обращения: 2 ноября 2021. Архивировано 6 августа 2021 года.
- ↑ Immunotherapy for Small Cell Lung Cancer (англ.). www.cancer.org. Дата обращения: 2 ноября 2021. Архивировано 2 августа 2021 года.
- ↑ Lung Cancer Immunotherapy (англ.). www.cancer.org. Дата обращения: 2 ноября 2021. Архивировано 23 июля 2021 года.
- ↑ Пембролизумаб зарегистрирован в России уже по трем показаниям. Дата обращения: 9 апреля 2018. Архивировано 30 августа 2019 года.
- ↑ В перечень ЖНВЛП на 2018 год вошел пембролизумаб. Дата обращения: 9 апреля 2018. Архивировано 9 апреля 2018 года.
- ↑ Пембролизумаб доказал эффективность у ранее нелеченых пациентов. Дата обращения: 9 апреля 2018. Архивировано 9 апреля 2018 года.
- ↑ Pembrolizumab. Дата обращения: 9 апреля 2018. Архивировано 10 апреля 2018 года.
- ↑ Атезолизумаб позволил снизить риск прогрессирования НМЛР. Дата обращения: 4 октября 2018. Архивировано 4 октября 2018 года.
- ↑ Дурвалумаб одобрен для лечения неоперабельного НМРЛ. Дата обращения: 2 марта 2018. Архивировано 3 марта 2018 года.
- ↑ Cancer today (англ.). gco.iarc.fr. Дата обращения: 27 мая 2021. Архивировано 31 марта 2019 года.
Литература
править- Ганцев Ш. К. Онкология: Учебник для студентов медицинских вузов. — М.: ООО «Медицинское информационное агентство», 2006. — 488 с. — 5000 экз. — ISBN 5-89481-418-9.
- Трахтенберг А. Х., Чиссов В. И. Клиническая онкопульмонология. — М.: ГЭОТАР МЕДИЦИНА, 2000. — 600 с. — 1500 экз. — ISBN 5-9231-0017-7.
- Онкология / В. И. Чиссов, С. Л. Дарьялова. — М.: ГЭОТАР МЕДИЦИНА, 2007. — 560 с. — 3000 экз. — ISBN 978-5-9704-0454-6.
Ссылки
править- Операция при раке лёгкого. Оперирует академик М.И. Перельман. Дата обращения: 2 октября 2010.