Tritlenek diglinu
Tritlenek diglinu (nazwa Stocka: tlenek glinu(III), zwyczajowo tlenek glinu), Al
2O
3 – nieorganiczny związek chemiczny z grupy tlenków, w którym glin występuje na III stopniu utlenienia. Występuje w wielu odmianach polimorficznych, z których najważniejsze to:
| |||||||||||||||||||||||||||||||
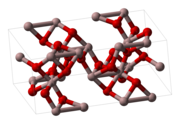 Struktura krystaliczna korundu | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Ogólne informacje | |||||||||||||||||||||||||||||||
| Wzór sumaryczny |
Al2O3 | ||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Masa molowa |
101,96 g/mol | ||||||||||||||||||||||||||||||
| Wygląd |
białe, bezwonne, higroskopijne ciało stałe | ||||||||||||||||||||||||||||||
| Identyfikacja | |||||||||||||||||||||||||||||||
| Numer CAS | |||||||||||||||||||||||||||||||
| PubChem | |||||||||||||||||||||||||||||||
| DrugBank | |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||
| Inne aniony | |||||||||||||||||||||||||||||||
| Inne kationy | |||||||||||||||||||||||||||||||
| Podobne związki | |||||||||||||||||||||||||||||||
| Jeżeli nie podano inaczej, dane dotyczą stanu standardowego (25 °C, 1000 hPa) | |||||||||||||||||||||||||||||||
- α-Al
2O
3 (korund) - postać najtrwalsza, odznaczająca się dużą twardością (9 stopień w skali Mohsa); temperatura topnienia 2053[3]–2072[4] °C, a wrzenia 2980[4]–ok. 3000[3] °C (dla korundu naturalnego temperatura topnienia wynosi 2015±15 °C, a wrzenia 2980±60 °C[4]); dobrze przewodzi ciepło, jest odporna na działanie czynników chemicznych, nierozpuszczalna w kwasach; powstaje podczas prażenia do 1000 °C odmiany γ; stosowana do wytwarzania materiałów szlifierskich (szmergiel) i ogniotrwałych
- γ-Al
2O
3 - biały, higroskopijny proszek, nierozpuszczalny w wodzie, rozpuszczalny w mocnych kwasach, otrzymywany przez łagodne prażenie wodorotlenku glinu; ma właściwości amfoteryczne, z alkaliami tworzy gliniany (np. NaAlO2), jest surowcem do otrzymywania metalicznego glinu metodą elektrochemiczną
Znane są również formy η, χ, δ i θ, różniące się właściwościami i budową krystaliczną[5]. Związek określony w 1916 r. jako β-Al
2O
3 okazał się w rzeczywistości glinianem sodu o wzorze NaAl
11O
17[6][7]. Ma on bardzo duże znaczenie jako stały elektrolit ze względu na wysokie przewodnictwo elektryczne[6].
Wytwórstwo przemysłowe
edytujPodstawową rudą aluminium, z której uzyskiwany jest tlenek glinu, są boksyty. Tak uzyskany tlenek glinu może służyć do produkcji aluminium.
Największym producentem tlenku glinu na świecie jest korporacja Alcoa; za nią plasują się Alcan i Rusal. Największymi wytwórcami aluminium są połączone Rio Tinto i Alcan, a kolejnymi Rusal i Alcoa[8].
W Polsce Jerzy Grzymek opracował metodę spiekowo-rozpadową (zwaną metodą Grzymka), w której do wytwarzania tlenku glinu oraz cementu portlandzkiego wykorzystuje się tylko surowce krajowe z pominięciem boksytów[9].
Inne tlenki glinu
edytujOprócz tlenku glinu(III) znane są również (rzadko spotykane):
- tlenek diglinu (tlenek glinu(I)), Al
2O[10] - monotlenek glinu (tlenek glinu(II)), AlO[11]
Zobacz też
edytujPrzypisy
edytuj- ↑ a b c d e f Tritlenek diglinu (nr 06285) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Polski. [dostęp 2012-08-11]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ Tritlenek diglinu (nr 06285) (ang.) – karta charakterystyki produktu Sigma-Aldrich (Merck) na obszar Stanów Zjednoczonych. [dostęp 2012-08-11]. (przeczytaj, jeśli nie wyświetla się prawidłowa wersja karty charakterystyki)
- ↑ a b CRC Handbook of Chemistry and Physics. Wyd. 83. Boca Raton: CRC Press, 2003, s. 4-2.
- ↑ a b c CRC Handbook of Chemistry and Physics. Wyd. 73. Boca Raton: CRC Press, 1993, s. 4-36.
- ↑ Gianluca Paglia, Determination of the Structure of γ-Alumina using Empirical and First Principles Calculations Combined with Supporting Experiments [online], rozprawa doktorska, Curtin University of Technology, 2004 [dostęp 2023-03-29] (ang.).
- ↑ a b Sodium-β-alumina and related phases, [w:] Norman N. Greenwood, Alan Earnshaw, Chemistry of the Elements, wyd. 2, Oxford–Boston: Butterworth-Heinemann, 1997, s. 249, ISBN 0-7506-3365-4 (ang.).
- ↑ Egon Wiberg, Nils Wiberg, Arnold Frederic Holleman, Inorganic chemistry, San Diego: Academic Press, 2001, s. 1020, ISBN 0-12-352651-5, OCLC 48056955.
- ↑ Aluminium. Gimme smelter. Are more big deals ahead?, „The Economist”, 19 lipca 2007 [dostęp 2023-03-29] (ang.).
- ↑ Elżbieta Kosacka, Metoda spiekowo-rozpadowa J. Grzymka wytwarzania tlenku glinu i cementu z surowców krajowych, „Przegląd Geologiczny”, 22 (5), 1974, s. 197-200 [dostęp 2023-03-29].
- ↑ Carsten Dohmeier, Dagmar Loos, Hansgeorg Schnöckel, Aluminum(I) and Gallium(I) Compounds: Syntheses, Structures, and Reactions, „Angewandte Chemie International Edition in English”, 35 (2), 1996, s. 129–149, DOI: 10.1002/anie.199601291 (ang.).
- ↑ D.C. Tyte, Red (B²Π–A2σ) Band System of Aluminium Monoxide, „Nature”, 202 (4930), 1964, s. 383–384, DOI: 10.1038/202383a0 (ang.).

