Natriumchloraat
| Natriumchloraat | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
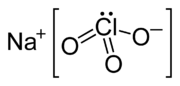
| |||||
Structuurformule van natriumchloraat
| |||||

| |||||
| Algemeen | |||||
| Molecuulformule | NaClO3 | ||||
| IUPAC-naam | natriumchloraat | ||||
| Molmassa | 106,44 g/mol | ||||
| SMILES | [O-]Cl(=O)=O.[Na+]
| ||||
| InChI | 1/ClHO3.Na/c2-1(3)4;/h(H,2,3,4);/q;+1/p-1/fClO3.Na/q-1;m
| ||||
| CAS-nummer | 7775-09-9 | ||||
| EG-nummer | 231-887-4 | ||||
| PubChem | 516902 | ||||
| Wikidata | Q407446 | ||||
| Beschrijving | Wit reukloos poeder | ||||
| Vergelijkbaar met | ammoniumchloraat, kaliumchloraat, natriumhypochloriet | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H271 - H302 - H411 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P220 - P273 | ||||
| Hygroscopisch? | ja | ||||
| Opslag | Verwijderd houden van hitte, vonken en open vlammen | ||||
| EG-Index-nummer | 017-005-00-9 | ||||
| VN-nummer | 1495 | ||||
| ADR-klasse | Gevarenklasse 5.1 | ||||
| LD50 (ratten) | (oraal) 1200 mg/kg | ||||
| LD50 (konijnen) | (oraal) 7200 mg/kg | ||||
| Fysische eigenschappen | |||||
| Aggregatietoestand | vast | ||||
| Kleur | wit | ||||
| Dichtheid | 2,5 g/cm³ | ||||
| Smeltpunt | 248-250 °C | ||||
| Kookpunt | (ontleedt) 260 °C | ||||
| Oplosbaarheid in water | 1010 g/L | ||||
| Goed oplosbaar in | water | ||||
| Geometrie en kristalstructuur | |||||
| Kristalstructuur | kubisch | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||
Natriumchloraat is een anorganische verbinding met als brutoformule NaClO3. De zuivere stof komt voor als een wit kristallijn poeder, dat zeer goed oplosbaar is in water.
Synthese
[bewerken | brontekst bewerken]Natriumchloraat wordt bereid door de elektrolyse van een oplossing van natriumchloride. Aan de kathode worden de natriumionen gereduceerd tot metallisch natrium. Door contact met water wordt hierbij natriumhydroxide gevormd:
Aan de anode worden de chlorideionen geoxideerd tot chloorgas, dat door het gevormde natriumhydroxide omgezet wordt in hypochloriet:
Dit wordt vervolgens verder geoxideerd tot het chloraat.
Natriumchloraat wordt ook spontaan gevormd door de ontleding van chloordioxide in de lucht, onder invloed van UV-licht (fotolyse) of in water (hydrolyse). Natriumchloraat is op die manier een bijproduct van het gebruik van chloor of chloorhoudende producten, bijvoorbeeld bij de ontsmetting van water.
Toepassingen
[bewerken | brontekst bewerken]Natriumchloraat is een oxidator en wordt toegepast als herbicide. Het is een zogenaamd totaal onkruidbestrijdingsmiddel, dat wordt ingezet om onbeteelde terreinen zoals wegen, paden, parkings, opritten en braakliggende terreinen te vrijwaren van onkruid. Merknamen van herbiciden die natriumchloraat bevatten zijn onder andere: Dacosol, Destructor, Gardiflor Netosol, Gorsit, Herbit, KB Occysol, Kilerb en Urturanet. Gewoonlijk wordt het verkocht in de vorm van wateroplosbaar poeder met 60 tot 90% natriumchloraat.
Andere toepassingen van natriumchloraat zijn:
- als bleekmiddel en oxidator, bijvoorbeeld bij de productie van chloordioxide om papierpulp te bleken of bij de behandeling van ertsen
- als looimiddel voor leer
Ondanks het feit dat natriumchloraat oxiderend werkt wordt het zelden in vuurwerk gebruikt, omdat de stof hygroscopisch is. Door een ionenuitwisseling kan er kaliumchloraat mee worden gevormd, dat wel in de pyrotechniek wordt gebruikt.
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Natriumchloraat is ingedeeld als een milieugevaarlijke stof: ze is toxisch voor in het water levende organismen en kan in een aquatisch milieu op lange termijn schadelijke effecten veroorzaken. Het mengen met zwavel levert - net als met alle andere chloraatzouten - potentieel gevaarlijke situaties op, als de zwavel reageert met vocht in de lucht tot zwavelzuur, kan het zwavelzuur reageren met natriumchloraat tot chloorzuur. Dit is een zeer onstabiel gas dat boven de 30% spontaan en explosief ontleedt.
Externe links
[bewerken | brontekst bewerken]- (en) Gegevens van natriumchloraat in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van natriumchloraat





