Nitrenio
| ione nitrenio | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| ione nitrenio | |
| Caratteristiche generali | |
| Massa molecolare (u) | 16,02260[1] |
| Numero CAS | |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| Frasi H | --- |
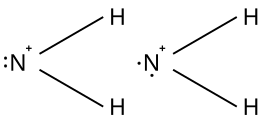
Uno ione nitrenio[2][3][4] in chimica è uno ione molecolare inorganico rappresentabile, nella sua forma più semplice, come H2N:+, e questo è lo ione nitrenio propriamente detto. Più in generale, al posto di uno o entrambi gli atomi di idrogeno possono esserci atomi di alogeno (FHN:+, F2N:+) o anche gruppi monovalenti. In chimica organica si incontrano ioni nitrenio analoghi in cui uno o entrambi gli atomi di idrogeno sono rimpiazzati da gruppi alchilici o arilici (RHN:+, R2N:+).[5] In R2N:+ si intende comprendere anche ioni nitrenio in cui N+ è parte di un ciclo, (ioni nitrenio ciclici), come quelli, ad esempio, derivanti dall'aziridina[6] o dalla pirrolidina.[7]
Almeno teoricamente, uno ione nitrenio sostituito potrebbe esistere in un'altra forma: al posto dei due sostituenti con legami semplici, la specie ha un sostituente legato con doppio legame: una forma analoga al particolare carbene >C=C: (vinilidene),[8] del tipo: >C=N:+.[9][10]
Gli ioni nitrenio sono specie ad alto contenuto energetico e come tali molto instabili, capaci di reagire velocemente con svariate altre specie molecolari con cui vengano a contatto; per questo li si incontra quasi sempre soltanto come fugaci intermedi di reazione.[10]
I termini "ione amminio", "ione immidonio" e "ione amminilio" a volte usati in passato per il nitrenio sono ora considerati obsoleti. Lo ione nitrenio non va confuso con lo ione nitronio (NO2+).
Struttura e proprietà
[modifica | modifica wikitesto]

Lo ione H2N:+ è precisamente isoelettronico al metilene H2C:. In esso l'atomo di azoto si trova ad avere una carica positiva e solo 6 elettroni nel guscio di valenza (di cui 2 di non legame) ed è quindi una specie elettron deficiente. La presenza della carica e del guscio elettronico incompleto sono due importanti fattori di instabilità: per lo ione nitrenio si trova infatti un'entalpia standard di formazione che è positiva (endotermicità) e molto elevata: ΔHƒ° = +1266,1±0,3 kJ/mol,[12] ma è minore di quella dei carbocationi di struttura simile e infatti per il carbocatione metilico (H3C+) si ha ΔHƒ° = +1095 kJ/mol.[13] I fattori che influiscono sono due: il radicale da cui deriva il nitrenio (•NH2) ha l'elettrone da allontanare sull'azoto (invece che sul carbonio meno elettronegativo), e infatti tale allontanamento (il suo potenziale di ionizzazione) costa 11,09 eV,[14] contro i 9,84 eV di •CH3;[15] inoltre, nel nitrenio l'azoto ha un legame in meno con l'idrogeno. Gli ioni nitrenio sono quindi specie chimiche più instabili dei corrispondenti carbocationi e perciò anche più reattivi.
Relazione con carbeni, carbocationi e nitreni
[modifica | modifica wikitesto]Queste caratteristiche della struttura elettronica degli ioni nitrenio, eccettuata però la carica, sono le stesse dei carbeni, ai quali gli ioni nitrenio sono precisamente isoelettronici.[16] Per altri versi, la presenza della carica positiva formale e il guscio di valenza incompleto fanno assomigliare gli ioni nitrenio ai carbocationi:[16] il nitrenio capostipite è anche isoelettronico al carbocatione metilico H3C+ (il protone in più presente in esso non influenza l'isoelettronicità).[3]
Gli ioni nitrenio singoletto differiscono dai nitreni (R–:N:) singoletto in quanto l'atomo di azoto in questi ultimi è neutro e ha due coppie solitarie; nello stato di tripletto differiscono dai nitreni tripletto, oltre che per la carica, in quanto non hanno alcuna coppia solitaria.[17]
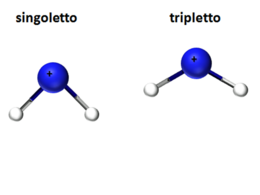
Lo ione nitrenio e i suoi derivati, come per carbeni e nitreni, possono esistere in due stati quantici a seconda dell'appaiamento, o meno, di 2 elettroni di non legame: nel primo caso si ha uno stato di singoletto e l'atomo N ha una coppia solitaria, non ci sono elettroni spaiati e lo ione è diamagnetico, nel secondo si ha uno stato di tripletto e N ha 2 elettroni spaiati (biradicale geminale) e lo ione è paramagnetico.[18] Come accade per i nitreni (e carbeni), negli ioni nitrenio lo schema di ibridazione di riferimento per N è di tipo sp2 per lo stato di singoletto e sp per quello di tripletto.[19]
Caratterizzazione degli stati quantici
[modifica | modifica wikitesto]Lo stato fondamentale del nitrenio capostipite è quello di tripletto (3B1, ·N·), dove dei due elettroni spaiati uno occupa un orbitale σ e l'altro un orbitale p ed entrambi hanno lo stesso spin (principio di Hund della massima molteplicità[20]).[21] Lo stato di tripletto per H2N:+ è più stabile del primo stato di singoletto (1A1, N:) di ~30 kcal/mol (~126 kJ/mol).[21]
In entrambi gli stati abbiamo ioni molecolari angolari (simmetria C2v):[22] da calcoli quantomeccanici risulta che l'angolo HNH nel nitrenio tripletto è maggiore che in quello singoletto (149,4° contro 107,1°); inoltre, nel primo il legame NH (102,5 pm) è leggermente più corto che nel secondo (104,3 pm);[21] uno studio successivo ricava valori molto simili: angoli di 151° e 107°, e lunghezze di 104 e 106 pm, rispettivamente.[23]
La presenza sull'atomo di azoto di un sostituente che abbia una coppia solitaria delocalizzabile, come qui il fluoro, stabilizza per risonanza lo stato di singoletto del nitrenio, dato che nella seconda forma limite, pur minoritaria nell'ibrido, l'atomo di azoto non ha più la carica positiva (trasferita a F) e, similmente al caso dei carbeni, raggiunge l'ottetto che non aveva:[24]
F−N:+−H ↔ +F=N:−H
Infatti, secondo calcoli teorici la stabilità degli stati si inverte passando dal nitrenio al monofluoronitrenio HFN:+, il singoletto è più stabile del tripletto di ~8,1 kcal/mol (~33,9 kJ/mol) e ancor più per il difluoronitrenio F2N:+ (~57,3 kcal/mol, o ~240 kJ/mol) ed anche gli altri ioni dialogenonitrenio X2N:+ (X = Cl, Br, I) hanno lo stato di singoletto come più stabile, sebbene in misura via via minore passando da F a I; inoltre, gli angoli XNX aumentano progressivamente nella stessa sequenza.[24][25]
Come nel caso ora visto del fluoro, anche l'ossigeno come sostituente stabilizza lo stato di singoletto, dato che nella corrispondente seconda forma limite (CH3O+=N:−H) è l'ossigeno, meno elettronegativo del fluoro, a sopportare la carica positiva: lo ione metossinitrenio (CH3O−N:+−H) singoletto è calcolato essere più stabile rispetto al tripletto di 113 kJ/mol (molto più di quanto fa il fluoro).[26]
Lo ione metilnitrenio (CH3NH+) ha il tripletto come stato più stabile, come il nitrenio capostipite HNH+, ma il divario energetico calcolato con lo stato di singoletto (ΔEST[27]) è minore. A tal proposito si fa l'ipotesi che la stabilizzazione dello stato di singoletto sia in questo caso dovuta a iperconiugazione:[26]
H3C−N:+−H ↔ H+ H2C=N:−H
Anche il dimetilnitrenio (H3C−N:+−CH3) ha lo stato fondamentale di tripletto (ΔEST = +8,8 kJ/mol). Invece, con sostituenti idrocarburici insaturi o aromatici, che hanno un doppio legame adiacente a N+ e che sono elettron-donatori per effetto mesomero (+M)[28] e che possono delocalizzare la carica positiva di N e completarne l'ottetto, si ha generalmente una maggior stabilità dello stato di singoletto:
CH2=CH−N:+−H ↔ +CH2−CH=N:−H
Così è per il vinile CH2=CH− (ΔEST = -23,7 kJ/mol) e il fenile C6H5− (ΔEST = -82,7 kJ/mol); similmente accade, sebbene meno efficacemente (gruppi -M), con gruppi acilici come il formile O=C(H)− (ΔEST = -10,5 kJ/mol) e l'acetile O=C(CH3)− (ΔEST = -40,2 kJ/mol).[26]
Relazioni con altre specie e possibile generazione in fase gassosa
[modifica | modifica wikitesto]Gli ioni nitrenio si possono generare in fase gassosa per protonazione (H+) o alchilazione (R+) di nitreni:[29]
H−:N: + H+ → H2N:+
H−:N: + R+ → RHN:+
R−:N: + R+ → R2N:+
Oppure rimuovendo un elettrone dal radicale amminico H2N: ·, il cui potenziale di ionizzazione vale 11,09 eV:[14]
H2N: · → H2N:+ + e
Lo ione nitrenio può essere trovato in vari tipi di plasma e in uno studio è stato possibile rivelare, tramite spettroscopia infrarossa, la formazione della specie [He: … H−N:−H]+, dove è presente un'interazione tra uno degli H del nitrenio e un atomo di elio.[30]

Derivati alchilici e arilici
[modifica | modifica wikitesto]Gli ioni nitrenio sono molto instabili, i tentativi di generare gli ioni nitrenio come specie distinte a lunga vita in condizioni stabili finora non hanno avuto successo e si stima che in acqua abbiano vite medie dell'ordine dei microsecondi.[31] Gli ioni aril-nitrenio sono oggetto di studio perché coinvolti in certi processi degenerativi del DNA. Questi intermedi esistono con tempi di vita dell'ordine dei microsecondi in acqua.[32] Sono studiati pure per utili processi sintetici.
Gli ioni nitrenio compaiono come intermedi in certe reazioni organiche, ad esempio nel riarrangiamento di Bamberger. Possono anche agire da elettrofili nella sostituzione elettrofila aromatica.[33]
Nella reazione degli ioni fenil-nitrenio con guanina, dai calcoli teorici del tipo funzionale di densità (DFT) si possono prevedere tutti i 22 addotti cationici isomeri che sono a energia minore dei reagenti separati. Questi cationi aventi bassa energia in soluzione corrispondono strutturalmente agli addotti più comunemente trovati quando la guanina reagisce, sia in vitro che in vivo, con ioni nitrenio biologicamente importanti.[34]
Note
[modifica | modifica wikitesto]- ^ (EN) IUPAC Commission on Isotopic Abundances and Atomic Weights., Atomic weights of the elements 2017, su Queen Mary University of London.
- ^ (EN) Compendium of Chemical Terminology, 2ed, IUPAC, ("Gold Book") (1997). Versione online: (2006–) "Nitrenium ions".DOI: 10.1351/goldbook.N04146
- ^ a b (EN) Paul G. Gassman, Nitrenium ions, in Accounts of Chemical Research, vol. 3, n. 1, 1º gennaio 1970, pp. 26–33, DOI:10.1021/ar50025a004. URL consultato il 30 novembre 2023.
- ^ Nitrenes and nitrenium ions, collana Wiley series of reactive intermediates in chemistry and biology, Wiley, 2013, ISBN 978-0-470-39059-7.
- ^ (EN) Robert A. Moss; Matthew S. Platz; Maitland Jones Jr., Reactive Intermediate Chemistry, 1ed, Hoboken (New Jersey,USA), Wiley-Interscience, 2004, p. 1084, DOI:10.1002/0471721492, ISBN 978-0471233244.
- ^ (EN) Christopher J. Cramer e Sharon E. Worthington, Electronic Structures of Aziridenium and Cyclopropylidene. Hypovalent Atoms in Three-Membered Rings, in The Journal of Physical Chemistry, vol. 99, n. 5, 1995-02, pp. 1462–1465, DOI:10.1021/j100005a015. URL consultato l'11 gennaio 2024.
- ^ Daniel E. Favley e Christopher J. Cramer, Aryl- and alkylnitrenium ions: singlet-triplet gaps via AB initio and semi-empirical methods, in Tetrahedron Letters, vol. 33, n. 13, 24 marzo 1992, pp. 1705–1708, DOI:10.1016/S0040-4039(00)91711-8. URL consultato l'11 gennaio 2024.
- ^ R. Fusco, G. Bianchetti e V. Rosnati, 2.4.4. Residui bi- e trivalenti di idrocarburi, in CHIMICA ORGANICA, volume primo, L. G. Guadagni, 1974, p. 31.
- ^ Michael B. Smith e Jerry March, MARCH’S ADVANCED ORGANIC CHEMISTRY, 6ª ed., 2007, p. 295, ISBN 978-0-471-72091-1.
- ^ a b T P Simonova, V D Nefedov e M A Toropova, Current approach to the problem of nitrenium ions, in Russian Chemical Reviews, vol. 61, n. 6, 30 giugno 1992, pp. 584–599, DOI:10.1070/RC1992v061n06ABEH000986. URL consultato il 1º dicembre 2023.
- ^ The Electronic Structure of Singlet and Triplet Nitrenium Ions, su pollux.chem.umn.edu. URL consultato il 1º dicembre 2023.
- ^ pubs.aip.org, https://pubs.aip.org/jcp/article/115/6/2582/185167/High-resolution-energy-selected-study-of-the. URL consultato il 1º dicembre 2023.
- ^ Methyl radical, su NIST Chemistry WebBook, SRD 69.
- ^ a b Jeffrey C. Stephens, Yukio Yamaguchi e Henry F. Schaefer III, The adiabatic and vertical ionization potentials of NH2 to the three lowest-lying states of NH2+ 1Dedicated to Professor Keiji Morokuma in celebration of his 65th birthday.1, in Journal of Molecular Structure: THEOCHEM, vol. 461-462, 2 aprile 1999, pp. 41–53, DOI:10.1016/S0166-1280(98)00420-5. URL consultato il 1º dicembre 2023.
- ^ (EN) NIST Office of Data and Informatics, Methyl radical, su webbook.nist.gov. URL consultato il 9 gennaio 2024.
- ^ a b Michael B. Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, Wiley, 2020, p. 278, ISBN 978-1-119-37180-9.
- ^ Nils Wiberg, Egon Wiberg e Arnold Frederik Holleman, XIV. Die Stickstoffgruppe (Pentele), in Anorganische Chemie, 103. Auflage, De Gruyter, 2017, p. 779, ISBN 978-3-11-026932-1.
- ^ (EN) San Yan Chu, Albert K. Q. Siu e Edward F. Hayes, Theoretical studies of the low-lying electronic states of the nitrenium ion (NH+2 and methylene, in Journal of the American Chemical Society, vol. 94, n. 9, 1972-05, pp. 2969–2972, DOI:10.1021/ja00764a012. URL consultato il 2 dicembre 2023.
- ^ (EN) Ashutosh Kar, Advanced Organic Chemistry (Structure & Mechanisms), 1ª ed., Scientific International Publishers & Distributors, 2017, pp. 128-129, ISBN 978-93-87025-20-2.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 25-27, ISBN 88-299-1470-3.
- ^ a b c G I Borodkin e V G Shubin, Nitrenium ions: structure and reactivity, in Russian Chemical Reviews, vol. 77, n. 5, 31 maggio 2008, p. 396, DOI:10.1070/RC2008v077n05ABEH003760. URL consultato il 1º dicembre 2023.
- ^ Experimental data for NH2+ (Amino cation), su Computational Chemistry Comparison and Benchmark DataBase.
- ^ (EN) Timothy J. Van Huis, Matthew L. Leininger e C. David Sherrill, Full Configuration Interaction Energies, Geometries, and Quartic Force Fields of the Nitrenium Ion, in Collection of Czechoslovak Chemical Communications, vol. 63, n. 8, 1998, pp. 1107–1142, DOI:10.1135/cccc19981107. URL consultato l'11 gennaio 2024.
- ^ a b Daniel E. Falvey e Anna D. Gudmundsdottir (a cura di), Nitrenes and nitrenium ions, collana Wiley series of reactive intermediates in chemistry and biology, Wiley, 2013, pp. 194-196, ISBN 978-0-470-39059-7.
- ^ (EN) Alberto Gobbi e Gernot Frenking, The singlet–triplet gap of the halonitrenium ions NHX + , NX 2 + and the halocarbenes CHX, CX 2 (X = F, Cl, Br, I), in J. Chem. Soc., Chem. Commun., vol. 0, n. 14, 1993, pp. 1162–1164, DOI:10.1039/C39930001162. URL consultato il 1º dicembre 2023.
- ^ a b c (EN) Daniel E. Falvey, Discrete Existence of Singlet Nitrenium Ions Revisited: Computational Studies of Non-Aryl Nitrenium Ions and Their Rearrangements, in ACS Omega, vol. 3, n. 8, 31 agosto 2018, pp. 10418–10432, DOI:10.1021/acsomega.8b01038. URL consultato l'11 gennaio 2024.
- ^ ΔEST è l'energia dello stato di singoletto rispetto al tripletto e ha segno meno se il singoletto è più stabile.
- ^ R.O.C. Norman, CHIMICA ORGANICA Principi e Applicazioni alla Sintesi, traduzione di Paolo Da Re, Piccin, 1973, pp. 49-52.
- ^ Maya Shankar Singh, Reactive intermediates in organic chemistry: structure, mechanism, and reactions, 1. ed, Wiley-VCH, 2014, p. 199, ISBN 978-3-527-33594-7.
- ^ (EN) O. Dopfer; D. Roth; J. P. Maier, Infrared spectrum and ab initio calculations of the He–HNH+ open-shell ionic complex, in Chem. Phys. Lett., vol. 310, n. 1, 1999, pp. 201-208, DOI:10.1016/S0009-2614(99)00731-9.
- ^ (EN) Marcia de Carvalho, Ana E. P. M. Sorrilha e J. Augusto R. Rodrigues, Reaction of aromatic azides with strong acids: formation of fused nitrogen heterocycles and arylamines, in Journal of the Brazilian Chemical Society, vol. 10, 1999-10, pp. 415–420, DOI:10.1590/S0103-50531999000500012. URL consultato il 13 febbraio 2023.
- ^ (EN) Marcia de Carvalho; Ana E.P.M. Sorrilha; J. Augusto R. Rodrigues, Reaction of Aromatic Azides with Strong Acids: Formation of Fused Nitrogen Heterocycles and Arylamines (PDF), in J. Braz. Chem. Soc., vol. 10, n. 5, 1999, pp. 415-420, DOI:10.1590/S0103-50531999000500012, ISSN 0103-5053.
- ^ (EN) Dariusz Bogdal, Microwave-assisted generation of carbazolyl nitrenium cation (PDF), in Arkivoc, vol. 2001, n. 6, 2001, pp. 109-115, DOI:10.3998/ark.5550190.0002.611, ISSN 1424-6376.
- ^ (EN) Parks J.M.; Ford G.P.; Cramer C.J., Quantum chemical characterization of the reactions of guanine with the phenylnitrenium ion., in J. Org. Chem., vol. 66, n. 26, 2001, pp. 8997-9004, DOI:10.1021/jo016066+, PMID 11749633.
Bibliografia
[modifica | modifica wikitesto]- (EN) George A. Olah; G. K. Surya Prakash; J. Sommer; A. Molnar, Superacid chemistry, 2ed, Hoboken, John Wiley & Sons, 2009, ISBN 978-0-471-59668-4.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Nitrenio
Wikimedia Commons contiene immagini o altri file su Nitrenio
