Allergia alimentare
| Allergia alimentare | |
|---|---|
 | |
| Specialità | immunologia |
| Eziologia | alimento e Allergeni alimentari |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | V15.01 |
| ICD-10 | T78.0 |
| OMIM | 147050 |
| MeSH | D005512 |
| MedlinePlus | 000817 |
| eMedicine | 135959 |
«Quod aliis cibus est aliis fuat acre venenum.»
«Quello che è cibo per un uomo è veleno per un altro.»
L'allergia alimentare è una reazione avversa che si sviluppa per una risposta immunitaria specifica e riproducibile all’ingestione di un determinato alimento[1][2][3][4][5].
Questa definizione che ha trovato ampio consenso viene però declinata da chi considera ipersensitizzazioni alimentari tutte le reazioni avverse non tossiche al cibo[6][7] o considera allergie alimentari solo le reazioni a componenti alimentari di natura proteica o mediate da anticorpi della classe IgE[8]. I segni ed i sintomi possono variare da lievi a gravi. Essi possono includere prurito, gonfiore della lingua, vomito, diarrea, orticaria, difficoltà respiratorie e bassa pressione sanguigna. Essi si verificano in genere da pochi minuti a diverse ore dopo l'esposizione. Quando i sintomi sono gravi, la condizione è nota come anafilassi e può avere esito letale. L'allergia alimentare è classificata come malattia cronica, può comparire ad ogni età, anche se c'è una prevalenza nei primi anni di vita, e alcune allergie dopo un certo tempo recedono, sviluppandosi naturalmente nell'individuo una tolleranza all'allergene[3][4][9].
Secondo alcune stime l'allergia alimentare interesserebbe circa il 5-8% dei bambini ed il 4-5% della popolazione adulta[3][10]. La percezione globale di "allergia alimentare" sarebbe molto più alta, intorno al 20% ed in aumento[5][11][12]. “L’allergia alimentare è molto probabilmente la patologia più comunemente auto-diagnosticata, ma spesso anche sovra-diagnosticata dal paziente, mentre è stato osservato che non raramente viene sotto-diagnosticata da medici e specialisti”[5].
Le reazioni allergiche comportano un coinvolgimento di meccanismi immunitari, IgE mediati e cellulo-mediati, che in termini fisiopatologici fanno parte delle ipersensibilità immediata di tipo I.
È opinione condivisa che questa patologia sia dovuta ad una soppressione dei normali meccanismi di tolleranza immunologica alle proteine ingerite con il cibo. Per la diagnosi occorre un'attenta anamnesi, seguita da accertamenti di laboratorio, e anche, se necessario, da test di scatenamento.
Solitamente la gestione della patologia consiste nell'educare il paziente ad evitare rigidamente l'allergene responsabile delle manifestazioni allergiche e contestualmente, in caso di ingestione non intenzionale dello stesso, iniziare una terapia antiallergica. Talvolta è anche possibile una prevenzione farmacologica.
Reazioni avverse al cibo
[modifica | modifica wikitesto]L'allergia alimentare può essere considerata non come un singolo disordine ma piuttosto come il meccanismo immunopatologico sottostante a vari disordini e sindromi[13][14];.
Sulla base delle linee guida redatte dalla National Institute of Allergy and Infectious Diseases[3] e dalla European Academy of Allergology and Clinical Immunology[15] le reazioni avverse agli alimenti possono essere suddivise come segue:
| Reazioni avverse agli alimenti | |||||
|---|---|---|---|---|---|
| Reazioni non tossiche | Reazioni tossiche | ||||
| interessano solo alcuni soggetti, con dipendenza dalla dose molto variabile | interessano tutti gli individui, dipendono chiaramente dalla dose | ||||
| reazioni immunomediate | reazioni non immunomediate | ||||
| IgE mediate Orticaria, SOA, angioedema, anafilassi |
Non IgE mediate Enteropatie proteine indotte, celiachia |
Miste (IgE e non IgE mediate) gastroenteriti eosinofile, dermatite atopica |
Cellulo mediate Sindrome di Heiner,enterocolite, proctite |
Intolleranze Intolleranze metaboliche o enzimatiche (al lattosio, favismo)., | |
Le reazioni non tossiche sono legate alla suscettibilità individuale nei confronti di certi alimenti e vengono suddivise in reazioni mediate dal sistema immunitario (allergia alimentare) e reazioni non mediate dal sistema immunitario (intolleranza alimentare). L’allergia alimentare, a sua volta, è ulteriormente distinguibile nelle forme IgE-mediate e non IgE-mediate. Mentre è ben conosciuto il meccanismo fisiopatologico delle prime, che devono essere prese in particolare considerazione nei casi a esordio acuto, le reazioni non IgE-mediate coinvolgono meccanismi umorali o cellulari ancora non del tutto chiariti. Di difficile collocazione la celiachia, che è stato proposto di definire "allergia IgA mediata", dal momento che vede coinvolto il sistema immunitario, ma con processi patogenetici diversi dalle tipiche allergie alimentari. Alcune reazioni non immunomediate, come quelle ai solfiti, fanno impropriamente classificare come allergeni sostanze che non sono allergeniche. Non c'è consenso scientifico sul classificare come allergie alimentari le reazioni allergiche ad alcuni apteni, proapteni e preapteni contenuti negli alimenti. Reazioni tossiche, come quelle ai funghi velenosi, a contaminazioni del cibo (insetticidi, pesticidi, ecc.) o ad additivi, e reazioni non immunomediate, come le intolleranze alimentari, non sono allergie alimentari.
Storia
[modifica | modifica wikitesto]I primi ad identificare le reazioni avverse agli alimenti furono Ippocrate (460-370 a.C.), il quale comprese che il cibo poteva essere causa di manifestazioni patologiche come l'orticaria e la cefalea, e successivamente Galeno (131-210 d.C.) che pare curasse malati di allergia alimentare.
Alcuni trattati, agli inizi del ottocento, attribuivano ad alcuni alimenti la causa delle dermatiti. Al medico londinese H.H.Salder nel trattato sull'asma pubblicato nel 1860 si deve il primo esplicito riferimento ad un nesso causale tra cibi, definiti da Salder, “irritanti” e asma[16].
Nei primi decenni del XX secolo sono state identificate le allergie alle proteine del latte e delle uova.
Epidemiologia
[modifica | modifica wikitesto]| Principali allergeni alimentari, età tipica di insorgenza e di eventuale risoluzione dell'allergia. | ||
|---|---|---|
| Allergia (incidenza %) | Insorgenza | Tolleranza |
| latte | 6-12 mesi | 5 anni (75%) |
| uovo | 6-24 mesi | 7 anni (76%) |
| arachidi | 6-24 mesi | persistente (si risolve il 20% dei casi a 5 anni) |
| soia | 6-24 mesi | 2 anni (67%) |
| frumento | 6-24 mesi | 5 anni (80%) |
| frutta a guscio | 1-7 anni | persistente (si risolve il 9% dei casi a 5 anni) |
| pesce | infanzia - età adulta | persistente |
| crostacei | età adulta | persistente |
| Legenda: Insorgenza: l'età tipica di insorgenza dell'allergia, Tolleranza: l'età tipica in cui emerge la tolleranza all'allergene (tra parentesi la percentuale di casi), Persistente: l'allergia è improbabile che guarisca “spontaneamente” | ||
Le indagini sulla prevalenza dell’allergia alimentare forniscono dati vaghi e discordanti a causa di differenze nei criteri di inclusione oltre che nelle metodologie di indagine, definizioni, popolazioni, ecc.[10][17][18]. Nei paesi sviluppati, una rilevante percentuale di persone ritiene di soffrire per qualche allergia alimentare, quando in realtà non ne soffre.[19]. Poche ricerche epidemiologiche riportano solo le allergie verificate con test di provocazione orale. In modo elusivo, una revisione sistematica delle ricerche sulla epidemiologia delle allergie alimentari conclude che "le allergie alimentari incidono sulla popolazione generale più del 1-2% e meno del 10%"[10]. L'allergia alimentare avrebbe la più alta prevalenza nei primissimi anni di vita. Questa tenderebbe a diminuire con l'età, raggiungendo a 10 anni di età l'incidenza che si riscontra negli adulti. Le variazioni nella prevalenza delle allergie alimentari sono chiaramente correlate all'età e ad alcune aree geografiche con una diversa distribuzione del tipo di sensibilizzazione, anche in relazione alle abitudini alimentari[4][17]. C'è un sostanziale consenso sul fatto che gli 8 principali alimenti allergizzanti ( latte[20], uovo[21], arachide[22], soia[23], frutta a guscio[24], crostacei[25], grano[26], pesci[27]) siano responsabili di oltre il 90% delle allergie alimentari. La maggioranza degli oltre 170 diversi allergeni alimentari individuati sensibilizzerebbero meno del 5 per 10000 della popolazione, la soglia per cui nella UE una malattia viene considerata rara[28]
In Europa sono rilevanti anche le allergia ai molluschi[29], sedano[30], lupino[31], sesamo[32], senape[33]. Recenti ricerche mostrano nei paesi avanzati un aumento di questa patologia in certi casi triplicata in una decina di anni[34][35].
Le reazioni a frutti e vegetali sarebbero in aumento, ma in genere non sono severe[36]. Viene, anche, riportato un aumento dell'allergia ai semi di sesamo, comunemente usato nei prodotti da forno[37].
In USA le allergie sono al VI posto tra le malattie croniche più frequenti[38].
Le allergie cutanee sono la tipica manifestazione dell'allergia alimentare e sono la malattia della pelle più frequente nei bambini con meno di 11 anni; queste forme sono aumentate dal 3% degli anni sessanta al 10% degli anni novanta. L'orticaria e l'angioedema che cono le manifestazioni cutanee più comuni delle allergie alimentari e colpiscono circa il 15% della popolazione ogni anno[39].
| Stime della prevalenza delle principali allergie alimentari negli infanti e negli adulti (dati USA)[10][40][41] | ||||
|---|---|---|---|---|
| Bambino | Adulto | |||
| totale allergie alimentari | 6 | 3,7 | ||
| latte | 2,5 | 0,3 | ||
| uovo | 1,3 | 0,2 | ||
| arachide | 0,8 | 0,6 | ||
| frutta a guscio | 0,2 | 0,5 | ||
| pesce | 0,1 | 0,4 | ||
| crostacei e molluschi | 0 | 2,0 | ||
| grano | N.D. | N.D. | ||
| soia | 0,2 | N.D. | ||
| Legenda: N.D.= non determinato | ||||
Infine 100-150 persone ogni anno muoiono negli USA per reazioni anafilattiche causate dall'ingestione di alimenti[42][43].
La situazione in Italia
[modifica | modifica wikitesto]Secondo questi dati pubblicati nel 2010[44] il problema delle allergie alimentari, specie in età pediatrica, in Italia è molto serio; infatti si stimano:
- 40 morti per shock anafilattico l'anno;
- 570.000 allergici < 18 anni;
- 270.000 allergici tra 0-5 anni;
- 150.000 allergici tra 10-18 anni;
- 80.000 allergici alle uova;
- 40-50.000 allergici a grano, pomodoro, soia, crostacei, frutta e verdura, noci e arachidi,
- 100.000 bambini devono usare latti ipoallergenici per un costo di 50 milioni di euro ogni anno che grava esclusivamente sulle famiglie;
- 1.500.000 gli adulti con allergia agli alimenti.
Quali siano le allergie più diffuse dipende dal paese[3], sia per le diverse abitudini alimentari, sia per una possibile predisposizione genetica. I fattori di rischio includono una storia famigliare di allergia, deficit di vitamina D, l'obesità e alti livelli di pulizia.[3][10] Le allergie si verificano quando le immunoglobuline E (IgE), che fanno parte del sistema immunitario dell'organismo, si legano alle molecole di cibo.[3] Solitamente il problema risiede in una proteina contenuta nel cibo.[10] Questa innesca il rilascio di sostanze chimiche infiammatorie come l'istamina.[3] La diagnosi è di solito formulata in base all'analisi della storia medica, con una dieta di eliminazione, attraverso il prick test o con gli esami del sangue per gli anticorpi specifici alimentari IgE.
Una esposizione precoce ai potenziali allergeni può essere una pratica protettiva. Il trattamento comprende principalmente l'evitare l'alimento scatenante la reazione e avere delle istruzioni su cosa fare in caso che si incorra in una esposizione.[10] Queste istruzioni possono includere la consegna di un autoiniettore di epinefrina(adrenalina) e indossare particolari distintivi per il soccorso medico.[3] I vantaggi dell'immunoterapia per le allergie alimentari non sono chiari e quindi, al 2015, non è un approccio raccomandato.[45] Alcuni tipi di allergie alimentari che si presentano durante l'età pediatrica, si risolvono con l'aumentare dell'età, in particolare quelle relative al latte, alle uova e alla soia; tuttavia più raramente per le altre, come per le noci e i frutti di mare.[10]
Mortalità e morbilità
[modifica | modifica wikitesto]L'assunzione di cibo può anche essere fatale in soggetti che hanno precedenti di asma (specie quelli con cattivo controllo dei sintomi), precedenti episodi di anafilassi con l'alimento incriminato, mancato riconoscimento dei sintomi precoci di anafillassi e/o ritardo nell'uso dell'adrenalina[46][47].
Gli adolescenti e i giovani adulti sembrano essere la popolazione più a rischio[43].
Le allergie alimentari causa di anafilassi potenzialmente fatale, sono dovute per l'80% dei casi ad arachidi e nocciole[48] Oltre a loro gli alimenti più frequentemente implicati sono crostacei e pesce, anche se molti altri cibi possono determinare l'anafilassi. La mortalità dovuta all'assunzione del latte è aumentata in modo notevole negli ultimi anni[49].
I sintomi più frequentemente osservati sono: prurito orofaringeo, angioedema/edema laringeo, stridore, tosse, dispnea, asma, arrossamento, orticaria e angioedema. I casi fatali presentano: edema laringeo severo, broncospasmo irreversibile, ipotensione resistente ai trattamenti (shock) o una combinazione di questi. A volte però si possono presentare problemi come nausea, vomito, diarrea o stitichezza a seconda del soggetto, ma porta anche problemi sessuali e relazionali, specialmente nei ragazzi d'età compresa tra i 14 e i 21 anni.
Un'indagine condotta presso il Dipartimento di Emergenza dell'Ospedale Maggiore della Carità di Novara (nel periodo 1º gennaio 2003-31 dicembre 2006), tra i ricoveri ospedalieri per anafilassi o per allergia alimentare; su 165.120 ricoveri in rianimazione con 6107 casi di reazione allergica sospetta; i casi sospetti di allergia alimentare sono stati: (1.4%) allergie alimentari e (0.8%) casi di anafilassi[50].
Eziologia
[modifica | modifica wikitesto]L'allergia è una patologia ad azione multifattoriale, il cui sviluppo è legato ad una combinazione di cause ereditarie ed ambientali. Viene riconosciuta una familiarità per le malattie atopiche e le allergie alimentari[37], anche se i fattori ambientali hanno un ruolo decisivo nel manifestarsi della patologia[48][51][52].
Genetica delle allergie alimentari
[modifica | modifica wikitesto]L'allergia alimentare potrebbe essere almeno in parte geneticamente determinata[53][54][55][56]. Il rischio di allergia alle arachidi, per esempio, è circa dieci volte maggiore in un bambino con un fratello anch'esso allergico alle arachidi rispetto alla popolazione generale. Così anche per le allergie alimentari non IgE-mediate[57][58], nelle quali è stata riscontrata una grande differenza etnica e familiare nell'incidenza, con la predominanza dei maschi caucasici.
Nelle famiglie ove più di un parente ha allergie, il rischio per i figli di avere allergie alimentari è molto alto, anche se non si possono predire le allergie alimentari piuttosto che altri tipi di allergia.
- 80% di probabilità di allergia se entrambi i genitori sono atopici con diverse manifestazioni associate (p. e. Asma e allergia alimentare insieme)
- 40-60 % di probabilità di allergia se entrambi i genitori sono atopici
- 25-40% di probabilità di allergia quando uno solo dei genitori è affetto da allergia
- 20-25% di probabilità di allergia quando un fratello è allergico
Un numero limitato di studi ha individuato una associazione tra specifici antigeni leucocitari (HLA) e specifiche allergie alimentari. I geni HLA-DR e HLA-DQ possono essere un fattore di rischio genetico per l'allergia alle arachidi.[59][60]
Allergeni alimentari
[modifica | modifica wikitesto]Si ritiene generalmente che qualsiasi alimento può suscitare una reazione allergica IgE mediata in un soggetto predisposto, e più di 170 alimenti sono stati segnalati per essere allergenici. Tuttavia, è ben riconosciuto, basandosi su molti studi, che l'allergia ad alcuni alimenti sembra essere particolarmente comune[61]. Le proteine ingerite sono i principali responsabili delle allergie alimentari. Qualunque proteina o frazione proteica può costituire una fonte allergenica, indipendentemente dal fatto che provenga da alimenti di origine animale o vegetale, da alimenti OGM o alimenti non modificati geneticamente. L'allegenicità degli alimenti è per lo più dipendente dalla configurazione strutturale delle loro proteine.[62][63][64][65]. Gli allergeni alimentari sono classificati come "maggiori" o "minori" in funzione della frequenza di sensibilizzazione. Gli 8 alimenti allergizzanti più comuni (latte, uova, arachidi, pesce, frutta a guscio, soia, crostacei, grano) sono anche definiti, specie nella letteratura anglosassone, allergeni maggiori. La maggiore o minore resistenza al calore, agli acidi o agli enzimi degli allergeni comporta un diverso assorbimento nel tratto gastrointestinale e diverse reazioni e disturbi.
L'istidina è il precursore dell'istamina presente in un largo numero di alimenti in una quantità intorno a 21 grammo/100 grammi parte edibile, e si degrada rapidamente in quest'ultima, a seguito dell'inappropriato trattamento del cibo durante l'immagazzinamento o la lavorazione. In questo modo, con un alimento possono essere assunte quantità importanti di istamina, che rafforza la reazione allergica ad allergeni presenti nell'alimento. Esiste un'allergia specifica all'istamina negli alimenti, ma l'antistaminico è anche il primo presidio contro le reazioni allergiche.
Additivi alimentari potenzialmente allergenici
[modifica | modifica wikitesto]Le reazioni allergiche agli additivi alimentari nei cibi non proteici sono poco comuni[61][66]. Vari aromi ed additivi alimentari possono contenere impurità proteiche (es. annatto, carminio, cocciniglia) o comportarsi come apteni inducendo reazioni allergiche sia ingeriti sia nei test cutanei:
| Categoria | Classificazione: E | Additivi alimentari potenzialmente allergenici |
|---|---|---|
| Coloranti | da E 100 a E 199 | Giallo crinolina, giallo-arancio S, azorubina, amaranto, eritrosina, Ponceau 4R, blue patent, indigo carminio, nero brillante, ossido di ferro rosso, cocciniglia, tartrazina |
| Preservanti | da E 200 a E 299 | Acido sorbico, Benzoato di sodio, Metabisolfito di sodio, Nitrato di sodio |
| Antiossidanti | da E 300 a E 321 | Butilidrossianisolo (BHA), propil-gallato, butilidrossitoluolo (BHT), tocoferolo |
| Esaltatori sapore | E621 | Glutammato monosodico |
Allergie crociate
[modifica | modifica wikitesto]| Reattività crociate Pollini-Alimenti e Lattice-Frutta[67][68][69][70][71] | |
|---|---|
| Pollini di betulla e ontano | sedano, prezzemolo, carota, finocchio, kiwi, fragola, lamponi, frutta secca, prugne, albicocche, ciliegie, pere, pesche, mele |
| Pollini di artemisia e ambrosia | girasole, castagna, sedano, prezzemolo, carota, finocchio, banana |
| Pollini di graminacee | frumento, pomodori, kiwi, anguria, meloni, ciliegie, agrumi, pesche, mandorle, prugne, albicocche |
| Pollini di parietarie | gelso, basilico, melone, ciliegie |
| Lattice | banana, kiwi, mango, melone, papaia, avocado, castagna, pomodoro |
L'allergia alimentare può manifestarsi anche come associazione di più allergie. Le reazioni crociate ad alimenti derivati da fonti filogeneticamente vicine, ad esempio piante o animali dello stesso genere, sono frequenti. Sono anche possibili reazioni crociate con allergeni derivati da fonti filogeneticamente distanti e con vie di esposizione che non comportano l'ingestione dell'allergene, come accade con i pollini inalati o con il lattice a contatto cutaneo. In genere nelle reazioni crociate le sensibilizzazioni da inalazione o da contatto cutaneo precedono le reazioni allergiche agli alimenti[69][72]. La reattività crociata è una delle possibili spiegazioni nel caso di reazioni allergiche ad alimenti mai consumati prima.
Patogenesi
[modifica | modifica wikitesto]Meccanismi fisiopatologici delle allergie alimentari
[modifica | modifica wikitesto]
I meccanismi fisiopatologici dell'allergia propri delle reazioni di ipersensibilità immediata di tipo I, la cui manifestazione clinica più grave è l'anafilassi, si manifestano sia come reazioni locali che sistemiche. La reazione sistemica generalmente fa seguito alla somministrazione endovenosa di un antigene precedentemente somministrato a cui l'ospite si è precedentemente sensibilizzato; questo porta ad uno stato di shock anche fatale.
La natura della reazione locale varia in funzione della porta di ingresso dell'antigene; essa può assumere la forma di un edema cutaneo localizzato (allergia cutanea o orticaria); secrezione nasale e congiuntivite (rinite allergica e congiuntivite), febbre da fieno o asma e manifestazioni gastrointestinali (vomito, diarrea, dolori addominali).

Le reazioni da ipersensibilità di tipo I si manifestano in due fasi:
- 1. fase immediata
- fase di sensibilizzazione (prima esposizione all'antigene)
- fase di scatenamento
- 2. fase ritardata o secondaria
Il mastocita (vedi immagine) ha un ruolo cruciale nello sviluppo della patologia. Esso è posto anatomicamente in zone strategiche per la risposta immunitaria, come i vasi sanguigni, le mucose, i nervi. L'attivazione del mastocita avviene grazie un legame tra i recettori e le IgE.
Un'altra tappa cellulare importante nel processo di ipersensibilità immediata di tipo I è quella determinata dalle cellule Th2: esse ricevono il segnale dalle cellule presentanti l'antigene (macrofagi e cellule dendritiche), dopo di che le Th2 si differenziano e producono varie citochine; queste ultime servono per attivare la produzione delle IgE da parte delle cellule B (fase di sensibilizzazione). I mastociti insieme ai basofili esprimono i recettori di membrana FcεR, dotati di elevata affinità per le IgE. Quando i mastociti sono ricoperti di IgE sulla superficie dopo una prima fase di sensibilizzazione, il successivo contatto con gli antigeni determina il legame tra 2 molecole di IgE ed il recettore FcεR.

Questo legame (antigene + 2 IgE + recettore FcεR) determina un'attivazione dei processi di trasduzione di segnale citoplasmatici del mastocita Ca++ dipendenti, che comportano la fusione delle vescicole lisosomiali piene di mediatori, soprattutto di istamina, con la superficie interna della membrana del mastocita e conseguente liberazione dei mediatori chimici immagazzinati (fase di scatenamento). Questi mediatori sono i responsabili dei sintomi tipici delle reazioni di ipersensibilità di tipo I sia sistemiche che localizzate ed inoltre attivano anche le risposte di tipo tardivo.

Le manifestazioni della risposta immune, in corso di allergia alimentare, sono molto variabili tra gli individui, tant'è che alcuni individui, pur producendo IgE specifiche per certi apteni proteici, non manifestano alcuna sintomatologia in seguito all'assunzione dell'alimento incriminato[73], anche se l'aumento dell'assunzione è correlato ad un aumento del rischio[74].
Le caratteristiche biochimiche di un alimento da sole non riescono spiegare la sua allergenicità. Infatti la naturale conseguenza di esposizione a nuovi cibi è lo sviluppo di una fisiologica tolleranza immunologica. La tolleranza immunologica orale dipende da una barriera intatta e immunologicamente attiva dell'intero tratto gastrointestinale. Questa barriera include le cellule epiteliali unite da giunzioni strette e da uno spesso strato di muco, così come l'orletto a spazzola; inoltre gli enzimi, sali biliari, e i picchi di pH contribuiscono degradandoli a rendere meno immunogeni gli antigeni proteici.
Ipotesi enzimatica
[modifica | modifica wikitesto]Tra i fattori responsabili dello scatenamento di una manifestazione allergica legati all'ospite vi è l'attività della PAF acetilidrolasi, enzima che degrada la PAF; questa provoca un aumento della gravità delle reazioni anafilattoidi[75] [76] [77] [78].
Ipotesi resistenza-proteica
[modifica | modifica wikitesto]Tra i fattori legati all'alimento va considerata la stabilità delle proteine contenute alla digestione e alla frammentazione chimico/enzimatica intestinale di certi semi (arachidi, cumino, anacardi). Queste proteine, infatti, rimangono integre più facilmente e possono scatenare reazioni allergiche alimentari anche molto gravi[79][80][81][82].
Ipotesi iposecrezione acida
[modifica | modifica wikitesto]In modo strettamente correlato alla precedente ipotesi, l'aumento delle manifestazioni di esofagite eosinofila, una forma di allergia alimentare, che è aumentata negli ultimi anni pare debba ricondursi all'uso di IPP (inibitori di pompa protonica); ciò perché la diminuita cloridia conseguente all'uso di questi farmaci rende più difficile la digestione delle proteine da parte dell'organismo con la conseguente aumentata permeabilità delle stesse proteine nella mucosa intestinale. L'ipotesi benché ancora non confermata, da studi sull'uomo, è molto plausibile ed interessante[83].
La letteratura scientifica a supporto in tal senso è relativamente cospicua e recente: [84] [85] [86] [87] [88] e ben si correla con l'ipotesi della resistenza proteica.
Ipotesi citochinica
[modifica | modifica wikitesto]Un recente studio[89] mette in relazione la quantità prodotta di IL-9 con la permeabilità intestinale alle proteine e la successiva esasperata risposta dei mastociti. L'IL-9, infatti, stimola il rilascio da parte delle mastcellule dell'istamina e delle proteasi e favorisce l'espressione del FcεRIα[90]. Anche il TNF ha un ruolo nella genesi delle enteropatie delle allergie alimentari[91].
Ipotesi Leaky gut
[modifica | modifica wikitesto]Una cospicua e recente letteratura getta le basi molecolari per la comprensione delle cause della sensibilizzazione alimentare da parte di antigeni proteici in persone sensibili[92]. Uno dei fattori predisponenti, da tempo ipotizzato per le malattie gastrointestinali è l'alterata funzione di barriera, denominata: leaky gut[93] [94] [95].
I parenti di primo grado di pazienti con malattie infiammatorie croniche intestinali, hanno un aumento della permeabilità intestinale in assenza di sintomi clinici [94] [96] [97].
I pazienti con allergia alimentare che hanno anche un aumento della permeabilità intestinale, hanno un aumento della gravità dei loro sintomi clinici[93]. Anche se le anomalie costitutive della permeabilità intestinale non sono state osservate sempre nei pazienti con allergia alimentare, si ipotizza che gli eventi ambientali, tra cui le infezioni e lo stress, possono alterare la permeabilità intestinale e promuovere la sensibilizzazione da parte dell'antigene alimentare[94].
Ipotesi microbiologica
[modifica | modifica wikitesto]Un altro aspetto di recente messo in evidenza mette in relazione le allergie alimentare con l'equilibrio dell'ecositema microbico dell'intestino e i meccanismi di difesa dell'ospite[98]. Secondo autori Giapponesi, infatti, nell'evitare le eccessive reazioni infiammatorie nell'intestino assumono un ruolo le componenti microbiche regolano direttamente le funzioni dei mastociti attraverso i recettori Toll-like. Questo può spiegare il motivo con il quale le manifestazioni allergiche sono in funzione di un non corretto mantenimento della flora simbiontica intestinale[99].
Una recente ricerca mette in relazione l'infezione virale da reoviridae come causa di modifiche immunologiche tali da innescare la risposta patologica delle allergie alimentari[100].
Il ruolo protettivo dei probiotici nei confronti della salute umana si estende ad una gamma di manifestazioni patologiche e tra queste spiccano le manifestazioni allergiche[101][102].
Probabilmente tutte le ipotesi sopra descritte concorrono in varia misura nella etiopagenesi delle allergie alimentare, e tutte offrono importanti chiavi di lettura e ricerca per la comprensione e la ricerca di soluzioni per questa diffusa patologia del benessere.
Patofisiologia
[modifica | modifica wikitesto]Comunemente i meccanismi causa di allergie alimentare e la conseguente classificazione fatta sulla base dei meccanismi etio-patologici viene suddivisa in tre categorie:
Tipicamente i comuni e "maggiori" allergeni alimentari responsabili delle forme IgE mediate sono delle glicoproteine solubili in acqua, con dimensioni comprese da 10 a 70 kDalton, esse sono relativamente stabili al calore, agli acidi, e alle proteasi del tratto gastroenterico.
Inoltre, la presenza di altri fattori immunostimolanti nel cibo possono anche contribuire alla sensibilizzazione immunologica di genere. Ad esempio, l'allergene delle arachidi è una glicoproteina (Ara h 1) che non solo è molto stabile e resistente al calore digestivo e alla degradazione enzimatica, ma agisce anche come coadiuvante dei linfociti T-helper2 (TH2) a causa della espressione di un "glycan adduct"[104]. L'immunità innata è rappresentata nell'intestino dalle: cellule natural killer, leucociti polimorfonucleati, macrofagi, cellule epiteliali con orletto a spazzola, recettori Toll-like e l'immunità acquisita è, invece, rappresentata dai linfociti intraepiteliali e dalla lamina propria, dalle placche di Peyer, dalle IgA, e dalle citochine; insieme forniscono una barriera capace di bloccare l'ingresso degli antigeni.
È noto come l'allergia alimentare sia più comune nei bambini: infatti la maggior permeabilità della mucosa intestinale nei neonati e la precoce esposizione agli antigeni allergizzanti sono stati proposti come possibile causa di sensibilizzazione nei neonati[105]. Tuttavia è stato dimostrato che la mucosa gastrointestinale raggiunge la sua piena maturità in termini di permeabilità dopo solo 2-3 giorni dalla nascita e l'aumento della permeabilità osservato in alcuni bambini con allergia alimentare sembra essere più una conseguenza, che la causa, della risposta infiammatoria di tipo allergico[106][107][108].
Al contrario, l'esposizione precoce agli alimenti potrebbe impedire lo sviluppo di allergie alimentari in alcune condizioni. Questo fatto è suggerito da un recente studio che ha dimostrato che i bambini israeliani, che spesso consumano un popolare spuntino a base di arachidi prima del 1 anno di età, hanno una prevalenza 10 volte inferiore nello sviluppare allergie alle arachidi, rispetto ai bambini degli Stati Uniti e del Regno Unito, dove le arachidi sono consumate raramente prima dei 12 mesi di età[109]; sono stati proposti per questo motivo altri fattori aggiuntivi come necessari per superare la fisiologica tolleranza orale.
Tra i fattori in grado di ridurre la tolleranza alimentare agli allergeni alimentari vi sono:
- l'aumento della permeabilità intestinale per fenomeni infiammatori della mucosa[110];
- l'aumento della permeabilità intestinale della mucosa per fenomeni irritativi dovuta a farmaci (aspirina)[111];
- la presentazione delle proteine alimentari per vie alternative come la mucosa respiratoria o cutanea[112]. In circa un terzo dei bambini con allergia alimentare coesiste l'asma[113];
- l'alterazione dell'equilibrio immunologico tra TH2 e l'antigene maggiore di istocompatibilità (MHC). Spesso dovuto all'assunzione delle proteine del latte vaccino durante l'allattamento[114]
. Ciò sembra (dovuto ad una perdita della funzionalità regolatoria determinata da CD4+, (TGF)-β, IL-10, CD25+ (queste sono T cells regolatorie), a favore della CD8+ (che è un tipo di T cells soppressoria). Le alterazioni sono dovute ad una anomalia genica che regola l'espressione del fattore FOXP3)[115]. L'IL-4 sembra avere un ruolo regolatatorio sulla suscettibilità intestinale all'infiammazione in corso di allergia alimentare[116].
Tra i fattori alimentari scatenanti sono stati recentemente ipotizzati come causa di allergie:
- diminuzione delle competenze immunologiche nei confronti in genere di batteri/virus/elminti (la cosiddetta ipotesi igienica);
- sbilanciamento a favore degli omega-6 a danno degli omega-3;
- diminuzione dell'assunzione degli antiossidanti alimentari e incremento/decremento della vitamina D della dieta[117].
Le forme non IgE mediate delle allergie alimentari sono una minoranza rispetto al totale e si verificano in assenza di anticorpi IgE specifici dimostrabili per gli alimenti sulla pelle o nel siero. Esse sono meno ben caratterizzate, ma in genere sono dovute ad una infiammazione acuta o cronica nel tratto gastrointestinale, dove gli eosinofili e le cellule T sembrano svolgere un importante ruolo nella genesi della manifestazione patologica[118] [119][120] . Nei pazienti con enterocolite indotta dal cibo il TNF-α ha un ruolo importante: esso, infatti, può essere misurato in vitro nei monociti di bambini con enterocolite indotta da alimenti proteici[121]. Chung e colleghi hanno anche trovato un aumento della colorazione per il TNF-α in biopsie duodenali dei bambini con enterocolite indotta dal cibo[122].
Per le forme miste come l'esofagite eosinofila, gli eosinofili e fattori chemiotattici svolgono un ruolo fondamentale. In questi soggetti l'Eotaxin-3 è del 50% sovraespressa nel tessuto esofageo rispetto ai controlli con esofagite cronica[123].
Localizzazione delle manifestazioni
[modifica | modifica wikitesto]Il risiedere delle cellule T stabilmente negli organi bersaglio può spiegare perché alcune malattie allergiche alimentari sono localizzate, e non hanno caratteristiche sistemiche come è il caso della dermatite atopica[124] e della esofagite eosinofila[110] [125] [126]. Le manifestazioni e la prevalenza delle allergie alimentari sono il risultato di un complesso, non del tutto conosciuto, meccanismo di relazioni tra ospite, ambiente, cause genetiche e alimentari; cosa, questa, che rende tra l'altro difficile lo sviluppo di terapie causali[127] [128] [129].
Complicanze
[modifica | modifica wikitesto]La complicanza più temuta delle allergie alimentari è lo shock di tipo allergico.
Clinica
[modifica | modifica wikitesto]Segni e sintomi
[modifica | modifica wikitesto]I quadri clinici tipici delle allergie alimentari, si distinguono in quattro tipi di manifestazioni principali e due occasionali, che possono essere presenti anche in varia combinazione tra loro nelle reazioni IgE mediate:
- Gastrointestinali: coliche intestinali, meteorismo, diarrea, nausea, vomito, Sindrome Allergica Orale (OAS), anafilassi gastrointestinale;
- Cutanee: Orticaria, dermatite atopica e flushing, eczemi o dermatiti da contatto ematogene;
- Respiratorie: rinocongiuntivite acuta, broncospasmo e/o asma allergico, (wheezing), angioedema;
- Generalizzate: shock anafilattico/anafilassi[130][131][132].
-
Dermografismo segno tipico (patognomonico) dell'orticaria
-
Dermatite atopica
-
Eruzione da farmaci
-
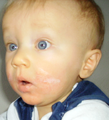
Angioedema: nel bambino
-
Angioedema: nell'adulto
-
Asma: prima e dopo l'episodio
-
Asma: prevalenza
Patologie associate
[modifica | modifica wikitesto]- Immunologiche e reumatologiche: vasculiti (è stata riscontrata un'associazione con la porpora di Schönlein-Henoch)[133], artriti: in particolare è stato osservato che nella mucosa intestinale di soggetti con artrite idiopatica giovanile sono presenti linfociti citotossici attivati, similmente a quanto avviene in corso di allergie. Ciò può far supporre un possibile ruolo degli allergeni alimentari nella patogenesi di questa malattia[134][135].
- Neurologiche e psichiatriche: emicrania (fra le varie ipotesi patogenetiche molti autori hanno ipotizzato il ruolo di alcuni allergeni alimentari)[136][137][138]. Tra i pazienti affetti è stata inoltre riscontrata un'aumentata incidenza di disturbi psichici quali ansia, sintomi depressivi, aggressività e disturbi del sonno, nonché un aumento del rischio di suicidio[139].
- Renali e genito-urinarie: in alcuni casi di enuresi del bambino è stato osservato un effetto scatenante di particolari alimenti[140]. Anche alcune forme di sindrome nefrosica possono avere un nesso con l'allergia: in particolare è stato ipotizzato che l'interleuchina 13, una citochina coinvolta nella risposta immunitaria IgE-mediata, possa essere responsabile della proteinuria nei pazienti con glomerulopatia a lesioni minime per la sua capacità di indurre l'espressione di una molecola, detta CD80, sulla superficie dei podociti.[141] Fra gli allergeni individuati quali possibili cause scatenanti di sindrome nefrosica (particolarmente in età infantile) vi sono le proteine del latte[142].
- Otorinolaringoiatria: di recente (maggio 2010) sono state segnalate come complicanza non comune, in corso di allergia alimentare, forme di rinite allergica[143].
Classificazione ezio-patologica
[modifica | modifica wikitesto]Considerando l'allergia alimentare un meccanismo immunopatologico sottostante a vari disordini e sindromi, l'inquadramento nosografico delle manifestazioni patologiche mediate dagli alimenti conseguenza di reazioni allergiche è complesso ed oggetto di ricerche in continua evoluzione.
| Manifestazioni immunopatologiche mediate dagli alimenti[1][10][48][103] | |||||
|---|---|---|---|---|---|
| Patologia | Patogenesi | Manifestazioni cliniche | Immunopatologia | Alimenti scatenanti più comuni | |
| Orticaria, Angioedema, | -IgE | Cutanee, gastrointestinali, sintomi respiratori | Reazione crociata con IgE che provoca il rilascio dei mediatori | latte, uovo, frumento, soia, arachidi, nocciole, pesce e crostacei | |
| Anafilassi | IgE | Reazione sistemica, rapida e progressiva su più organi; può comportare il collasso cardiovascolare | Massivo rilascio di istamina | Arachidi, frutta a guscio, latte, uova, frutti di mare, pesce | |
| Sindrome orale allergica (SOA) | IgE | Sintomi orofaringei moderati, primariamente: prurito, -angioedema | Sensibilizzazione primaria alle proteine omologhe alle proteine del cibo di certi tipi di frutta/verdura | Frutta e vegetali crudi | |
| Anafilassi esercizio indotta cibo-dipendente (FDEIA) | IgE | Anafilassi scatenata dal cibo solo se l'ingestione è seguita dall'esercizio fisico | Incremento del rilascio dei mastociti e alterazione della permeabilità intestinale quando l'assunzione del cibo è seguita dall'esercizio fisico | Frumento, crostacei e sedano sono i cibi più comunemente scatenanti | |
| Rinite, asma | IgE | sintomi che possono accompagnare la reazione allergica al cibo, possono essere scatenati dall'inalazione di cibo, in polvee o aerosol. | Dipende dagli alimenti | ||
| -Dermatite atopica / Eczema | Mista: IgE/ non-IgE | Infiammazione cronica della pelle con prurito | Attivazione IgE mediata dai mastociti (-mast cell) cutanei; fase ritardata: infiltrazione di cellule infiammatorie, inclusi gli -eosinofili e -cellule T | Uova, frumento, latte, soia e altri | |
| Gastroenteropatia Eosinofila | Mista: IgE/ non-IgE | Disfagia, crescita modesta, disturbi addominali: -nausea e -vomito | Infiltrazione Eosinofila del tratto gastrointesinale, giocano un ruolo cruciale i mediatori degli eosinofili, p.e.: IL-5 e eotassina | Diversi cibi | |
| Enterocoliti indotte dalle proteine alimentari (FPIES) | non-IgE | Emesi ritardata, -diarrea 2 ore dopo l'ingestione, nei casi severi: nel 15% -ipertensione | Incremento del -TNFα, decremento del TGFα | Latte, soia, cereali | |
| Proctocoliti indotte dalle proteine alimentari | non-IgE | Strie di sangue nelle feci dei bambini | Infiltrazione eosinofila del -colon | Latte, e soia, insorge anche assumendo il latte materno | |
| Sindrome di Heiner | non-IgE | Infiltrati polmonari, anemia | Latte | ||
| Celiachia/allergia IgA mediata | non-IgE | Disordine autoimmune che comporta enteropatie e malassorbimento | può manifestare crescita ridotta, anemia, dermatiti erpetiformi, anormalità ossee. | Cereali con glutine | |
| Dermatite allergica da contatto | Cellulo-mediata T-cell | eczema come risposta ad apteni contenuti negli alimenti | Vari | ||
Procedure diagnostiche per le allergie alimentari
[modifica | modifica wikitesto]Per porre una diagnosi di certezza di allergia alimentare verso uno o più alimenti, occorre eseguire in sequenza una serie di accertamenti diagnostici:
- I livello
- Test cutanei:
- Prick testo o prick by prick
- Misura delle IgE specifiche (RAST test)
- II livello
- Dieta di eliminazione
- Prova da scatenamento orale in doppio cieco
-NB: altri tipi di accertamenti diagnostici sono prospetticamente interessanti, ma non sono validati in modo univoco dalla comunità scientifica; per cui vanno considerati un complemento dei test e accertamenti sopraindicati.
Per riconoscere un'allergia alimentare rispetto ad un'intolleranza alimentare, occorre fare una diagnosi differenziale.
Test ed esami di laboratorio
[modifica | modifica wikitesto]Test cutanei
[modifica | modifica wikitesto]Generalità
[modifica | modifica wikitesto]Sono usati correntemente per la diagnosi delle allergie alimentari, sono i test di screening più comuni per le allergie alimentari e possono anche essere eseguite sui neonati nei primi mesi di vita (sono però affidabili dopo i 3 anni). Tuttavia, l'affidabilità dei risultati dipende da molteplici fattori, quali l'utilizzo opportuno degli allergeni da testare insieme ad una precisa tecnica di somministrazione, nonché la contemporanea assunzione di farmaci che possono interferire con i test come per esempio gli: antistaminici o i cortisonici
Quando questi test vengono utilizzati con opportuni controlli standard, per esempio un test con un campione positivo a base di istamina ed uno negativo a base di soluzione salina; forniscono criteri precisi per la diagnosi facilmente riproducibili con un costo minimo e con rischi per i pazienti trascurabili. Questo metodo è generalmente affidabile per escludere le allergie alimentari immediate; con precisione predittiva del 90% se il risultato è negativo; mentre questa precisione scende al 50% se positivo. Ciò limita l'interpretazione clinica del risultato, e quindi insieme ai testi in vitro occorre valutare attentamente anche l'anamnesi.
Il risultato va confermato sempre da un test di risomministrazione dell'alimento incorminato, a meno che il paziente abbia già una storia certa di allergia alimentari.
Metodica
[modifica | modifica wikitesto]I test intradermici sono:
- prick test
- prick by prick (dall'inglese: to prick = pungere)
- scratch test
- patch test.
Questi sono usati sia per le allergie alimentari che per le allergie respiratorie.[144]
Per l'interpretazione dei test è richiesta esperienza e competenza; i risultati ottenuti, infatti, vanno sempre correlati ai sintomi e all'anamnesi del paziente e spesso sono necessari ulteriori test per porre una diagnosi di certezza.
Durante l'esecuzione di tali esami è necessario tenere a portata di mano un kit d'emergenza; si possono infatti, seppur raramente, manifestare reazioni gravi, fino allo shock anafilattico.
Il prick test, se ripetuto più volte con lo stesso allergene, può determinare a sua volta sensibilizzazione.
Il prick by prick viene usato solo per le allergie alimentari; in questa metodica la lancetta utilizzata per scalfire la cute del paziente viene inoculata preventivamente nell'alimento che si vuole testare (frutta o verdura).
Lo scratch test è simile al prick test ma è meno sensibile e di più lunga esecuzione, perciò poco usato. Dopo la pulizia della cute si pratica con uno strumento acuminato un leggero graffio (in inglese, scratch) di 2 mm di lunghezza evitando il sanguinamento, dopo di che una goccia della soluzione contenente l'allergene viene posta al di sopra della lesione provocata e delicatamente si effettua uno sfregamento sull'area graffiata per farla penetrare la soluzione nella lesione; la lettura viene eseguita dopo 10-30 min.
Il patch test è indicato nella diagnosi delle dermatiti allergiche da contatto. Consiste nell'applicazione sulla cute della schiena di cerotti medicati con l'allergene; sono testati routinariamente 31 allergeni. Il cerotto si rimuove dopo 24-72 ore, e si controlla se nella zona della cute di applicazione si è verificato un arrossamento. Questo test viene usato nelle allergie alimentari per verificare la reattività ad alimenti in caso di esofagite eosinofila[145], enterocolite[146] e dermatite atopica[147]. Il valore di questo test è però incerto e andrebbe confermato da studi più oggettivi rispetto a quelli fin qui effettuati[148].
- Vengono fatti sulla regione volare dell'avambraccio con opportune lancette a punta sottile che iniettano l'allergene da testare; è importante usare una lancetta per ogni allergene, rispettando delle distanze minime tra un allergene ed un altro (2,5 cm).
- Vanno fatti confronti con dei controlli negativi con soluzione salina e con controllo positivo con l'istamina (10 ng/mL in sol. fisiologica).
- La lettura va fatta dopo 5 min per l'istamina e dopo 15 per gli allergeni, è consigliato l'uso di un cronometro. Sono di dubbia interpretazione le risposte che si presentano dopo 15-20 min.
- I test sono poco rischiosi, ma è bene fare una prova preliminare con l'allergene non inoculato sottocute con la lancetta e verificare se si presenta così una reazione; in tal caso è bene non eseguire il test per il rischio di una reazione grave di tipo anafilattico (oltre che per l'inutilità del test in tale circostanza).
Limiti dei test cutanei
[modifica | modifica wikitesto]In generale questi test si utilizzano su soggetti di età non inferiore a 3 anni. Non vanno però effettuati nei seguenti casi:
- lesioni da grattamento o da patologie dermatologiche nella zona di somministrazione del test.
- pazienti con dermografismo, per un'accentuata reattività da parte della cute da parte di questi pazienti.
- uso di farmaci antistaminici e/o steroidi e/o immunosoppressori, che inibiscono i meccanismi immunologici e quindi la reattività della cute (stesso effetto possono avere, sebbene in misura molto minore, i betabloccanti).
-
Scracth test
-
Pacht test
-
Esempio di reazioni cutanee al test
Sierologia
[modifica | modifica wikitesto]I test sierologici in vitro sono di semplice esecuzione, alcuni però sono fatti con una metodica radioimmunologica che complica alquanto il test e fa aumentare i costi. Alcune linee guida considerano alcuni test sierologici di non provata utilità per la diagnosi di allergia alimentare, definendoli "inappropriati"[7][149].
Dosaggio delle IgE specifiche
[modifica | modifica wikitesto]Consigliato per confermare casi dubbi ai test cutanei e soprattutto per la valutazione in bambini piccoli o soggetti con gravi dermopatie.
Si utilizza un test detto RAST (Radio Allergo Sorbent Test, test di radio-allergo-assorbimento) che ha qualche analogia con il PRIST. L'allergene è legato covalentemente ad un dischetto di carta e reagisce con l'anticorpo IgE specifico eventualmente presente nel siero in esame. Dopo che le IgE non specifiche sono state eliminate con lavaggi, si aggiungono anticorpi anti-IgE marcati con 125I, i quali si legano al complesso disco-allergene-IgE. Si legge a questo punto la radioattività in un contatore per emittenti gamma. Questa sarà proporzionale alla quantità di IgE specifiche presenti.
Il RAST è meno sensibile ma è più specifico del test cutaneo, oggi poi le nuove tecniche laboratoristiche come il CAP Sistem FEIA o UniCAP, ne hanno elevato la sensibilità e la praticità d'uso.
Conta degli eosinofili
[modifica | modifica wikitesto]Per poter fare la conta degli eosinofili va fatta prima una diagnosi differenziale con: le infezioni (causa di elevato numero di neutrofili), con le anomalie congenite delle ossa turbinate, con l'irritazione da agenti irritanti, ed altre eziologie di natura non allergiche.
Benché il numero degli eosinofili si possa ottenere come conta differenziale rispetto al numero dei leucociti totali, si usano per il conteggiosi degli stessi metodiche più sofisticate che colorano gli eosinofili in modo specifico (soluzioni di Pilot o Tannen). Il numero totale degli eosinofili per mm 3 va da 0 a 450 nell'adulto, da 50 a 700 nel bambino e da 20 a 850 nel neonato.
Dosaggio totale delle IgE
[modifica | modifica wikitesto]Un elevato livello di IgE sieriche può avvalorare il sospetto diagnostico di una malattia allergica. Poiché, però, esiste un certo grado di sovrapposizione tra i valori di IgE nei soggetti normali e negli allergici, una quantità normale di IgE non esclude una diagnosi di allergopatia.
Le IgE vengono valutate con una metodica radioimmunologica: il cosiddetto PRIST (Paper Radio Immuno Sorbent Test o test di radio-immuno-assorbimento su carta). Questo test utilizza un substrato solido di carta; cui sono legati gli anticorpi anti-IgE. dopo opportuni lavaggi, se sono presenti IgE nel siero in esame, queste vengono legate dagli anticorpi attaccati al dischetto di carta. Si usano anticorpi anti-IgE marcati con 125I. che fissano le IgE legate al dischetto e quindi, dopo un ulteriore lavaggio, si effettua la lettura del dischetto di carta in un contatore per emissioni gamma. La radioattività del complesso sarà direttamente proporzionale alla concentrazione delle IgE nel siero in esame. Nell'adulto i valori normali di IgE sieriche sono inferiori a 0,025 mg/dl.
Metodi rapidi
[modifica | modifica wikitesto]Point of care test Di recente si sono affermati per la loro praticità i metodi di auto indagine domiciliare (point of care testing); tra questi in ambito allergologico merita una segnalazione l'apparecchiatura ImmunoCAP Rapid (ICR). Questo strumento simile ad un glucometro per l'analisi domiciliare della glicemia, analizza una goccia di sangue periferico ed è utile per la diagnosi di primo livello di: asma, eczemi e riniti. Tra gli allergeni alimentari testati vi sono: uova, latte, insieme ad altri comuni allergeni non alimentari.
La riproducibilità del dato è buona, con una percentuale di falsi positivi dell'1%[150]. Lo strumento risulta quindi utile per una prima diagnosi ambulatoriale delle più comuni allergie, soprattutto in ambito respiratorio [151].
Prova da scatenamento orale
[modifica | modifica wikitesto]La prova da scatenamento orale è utilizzata per confermare la diagnosi di allergia alimentare ad un alimento.
Essa viene condotta sotto controllo medico, consiste nella somministrazione del cibo sospetto per via orale in modo graduale; con una valutazione attenta degli eventuali sintomi subentranti. In caso di presentazione di questi si deve sospendere la somministrazione ed eventualmente si somministrano farmaci sintomatici. Le prove da scatenamento sono preceduta da un opportuno periodo di eliminazione del cibo sospettato, il test è condotto a condizione che il paziente non usi farmaci che possono interferire; inoltre la prova va effettuata in ambiente ospedaliero ed è una buona norma prudenziale che il paziente abbia già effettuato un accesso venoso (catetere già inserito in vena), per un eventuale rapida somministrazione di farmaci di emergenza in caso di shock subentrante.
La metodica più affidabile è quella condotta in doppio cieco (né il paziente né il medico devono conoscere quale è il campione con il cibo incriminato); ma spesso si accetta il singolo cieco, in questo caso solo il paziente non conosce quale è il campione con il cibo incriminato.
Le prove da scatenamento non si effettuano quando c'è il sospetto di una reazione anafilattica o quando i test già effettuati permettono una certezza diagnostica nei confronti dell'alimento incriminato dell'allergia alimentare.
Le varie tipologie di prove da scatenamento orale sono:
- test in aperto: il cibo è assunto in modo solito, però quando il risultato è ambiguo va eseguita la prova in cieco.
- test in cieco singolo: il cibo sospetto va miscelato ad altro cibo e deve essere non riconoscibile da parte del paziente; in questo caso un errore di valutazione per una soggettività da parte del medico è possibile, per quanto questo errore è considerato statisticamente modesto.
- test in doppio cieco con placebo: l'alimento sospetto va inserito in capsule, esse sono di due tipi: con il cibo e senza il cibo (placebo). Queste vanno assunte a distanza di giorni le une dalle altre. Con questo tipo di esame l'errore di valutazione del medico e del paziente si riduce al minimo. Questa procedura è considerata il criterio standard per la diagnosi di allergia alimentare, ed è usata soprattutto nelle indagini di ricerca. È l'unico metodo completamente oggettivo per avere la certezza di una reazione avversa al cibo.
Diagnosi differenziale
[modifica | modifica wikitesto]Allergia vs intolleranza
[modifica | modifica wikitesto]La prima differenza va fatta tra allergia alimentare vera e intolleranza alimentare, nella tavola seguente sono mostrate le differenze:
| Allergia alimentare | Intolleranza alimentare |
|---|---|
| Il sistema immunitario è coinvolto (con reazioni di tipo anafilassi) | Il sistema immunitario non è coinvolto (con reazioni di tipo anafilassi) |
| Ha un ristretto numero di cause | Le cause sono diverse |
| La reaziona in genere si verifica poco dopo l'ingestione del cibo, (da min a ore) | I sintomi di solito si verificano dopo qualche tempo la ingestione del cibo (giorni) |
| Un singolo ed una piccola quantità di allergene è sufficiente a scatenare una reazione rapida e violenta, dopo l'avvenuta sensibilizzazione | Sono necessarie grandi quantità o un'assunzione regolare dell'alimento |
| I sintomi sono inequivocabilmente riconducibili all'allergia in genere | I sintomi non sono di solito così facilmente riconducibili ad una causa particolare; il perché non è chiaro. |
| Può essere pericolosa per la vita | Non pericolosa per la vita |
| Le manifestazioni cliniche rimangono costanti all'esposizione dello stesso allergene | La reazione alla sostanza che la provoca spesso può variare a seconda di condizioni e/o circostanze della persona |
Patologie varie
[modifica | modifica wikitesto]La diagnosi differenziale va anche posta con le seguenti patologie:
- Spasmi dell'esofago
- Disfunzione delle corde vocali
- Esofagite
- Orticaria
- Avvelenamento
- Gastrite acuta
- Gastrite cronica
- VIPoma
- Malattia di Whipple
Diagnosi precoce
[modifica | modifica wikitesto]La diagnosi di allergia alimentare si basa ancora principalmente sulla storia clinica dettagliata e un completo esame fisico del soggetto. Test clinici o di laboratorio servono solo come strumento aggiuntivo per confermare la diagnosi. Le indagini standard comprendono i test cutanei come il prick test e test in vitro per gli anticorpi IgE specifichi, e le prove orali da scatenamento alimentari. Queste ultime quando correttamente eseguite continueranno ad essere il gold standard nell'iter diagnostico. Recentemente, i metodi diagnostici non convenzionali vengono sempre più frequentemente utilizzati, ma non possono sostituirsi ai precedenti; per il rischio che i risultati non siano correlati con l'alimento causa di allergia.
Risvolti psicologici
[modifica | modifica wikitesto]La mancanza di opportuni strumenti di indagine sull'impatto psicologico delle allergie alimentari nei pazienti e nei loro familiari, rende difficile quantizzare le implicazioni psicopatologiche di questa patologia di frequente risconttro nella popolazione specie giovanile [152]. Fermo restando che i fattori psicologici non permettono di prevedere la severità dei sintomi nei pazienti ipersensibilità da allergia alimentare [153].
Il primo studio che conferma la presenza di un'associazione tra allergie e disturbi dell'umore e d'ansia secondo i criteri del DMS IV è lo studio canadese di Patten SB, e Williams JV del 2007[154]. Lillestøl K, et al. 2010[155] valuta la depressione e l'ansia, con opportune scale e questionari, in soggetti con diagnosi di IBS e allergia alimentare (auto segnalata); rilevando con i criteri del DSM IV un aumento della patologia ansiosa del 34% e del 16% per quella depressiva.
Herbert LJ, et al. nel 2008 rileva che in soggetti con allergia alimentare, che hanno esperito un episodio di anafilassi rispetto a soggetti allergici che non hanno avuto episodi, i livelli di autostima sono più bassi e sono rilevabili tratti ansiosi e depressivi, indicando così come un episodio di anafillassi può essere un indicatore affidabile di stress psicologico[156]
Nella celiachia si riscontrano tassi elevati di depressione[144].
L'uso di farmaci per le allergie (specie respiratorie, FDEIA compresa) come i cortisonici sistemici o gli inibitori dei lucotrieni, sono associati ad alti tassi di insonnia, depressione e anche di rischio di suicidio; cosa che impone un'attenta vigilanza in tal senso da parte dei clinici[139]. La FDA di nell'agosto del 2009 ha emanato un'avvertenza (box warning) riferito al rischio di suicidio indotto da inibitori dei lucotrieni: Montelukast, Zafirlukast e Zileuton[144].
Trattamenti
[modifica | modifica wikitesto]Evitamento
[modifica | modifica wikitesto]La strategia per evitare l’esposizione ai cibi allergenici è basata su: • identificazione precisa dell’alimento che ha causato la reazione • riconoscimento degli allergeni cross-reattivi presenti in altri cibi • educazione del soggetto allergico e di chi ne ha cura sulle misure precauzionali necessarie ad evitare la esposizione ad allergeni nascosti • educazione alla lettura delle etichette • attenzione nel mangiare fuori casa[4].
Diario dietetico
[modifica | modifica wikitesto]Il diario dietetico consiste nel tenere un registro degli alimenti assunti in ordine cronologico e dei relativi aventi avversi e sintomi correlati con l'assunzione dell'alimento.
- È un sistema di facile attuazione non costoso che permette di documentare la frequenza e la relazione di causa/effetto con i cibi assunti, con il vantaggio di focalizzare i pazienti sulla corretta gestione della loro dieta.
- L'utilità diagnostica è però limitata, specie se gli alimenti manifestano reazioni a distanza di tempo dalla loro assunzione.
- Questo diario è inoltre, raramente utile per identificare gli alimenti implicati in una reazione avversa, infatti non permette di fare la diagnosi con certezza specie quando i sintomi sono in ritardo o rari.
Dieta di eliminazione
[modifica | modifica wikitesto]Viene comunemente usata per fare diagnosi e per finalità terapeutiche.
Il suo uso per fini diagnostici consiste nell'eliminare tutti gli alimenti o gruppi di alimenti sospetti per un certo periodo di tempo (circa 7-10 giorni) contemporaneamente ad un controllo della diminuzione dei sintomi. La dieta di eliminazione è più utile nel valutare le situazioni croniche. Il successo di questa dipende dalla certezza di aver eliminato dalla dieta l'alimento sospetto. Le limitazioni di questo metodo sono legate solo ai pregiudizi del medico e del paziente, specie se nel tempo il paziente non sopporta la limitazione che questa dieta comporta.
Una volta individuati gli allergeni, questi vengono rimossi dalla dieta del paziente a tempo indeterminato, salvo la risoluzione della patologia nel tempo, caso nel quale spesso si prescrive comunque una dieta di mantenimento che permette l'assunzione di cibi contenenti l'allergene in determinate quantità e giorni della settimana.
Terapia farmacologica di emergenza
[modifica | modifica wikitesto]
- Kit di emergenza antiallergico: nei pazienti che hanno un'allergia di tipo I e che possono sviluppare un episodio di tipo anafilattico: Il kit deve contenere un autoiniettore di epinefrina[144] antistaminici e steroidi iniettabili, utile una segnalazione nei propri documenti del tipo di allergia.
Dosaggi dell'adrenalina
[modifica | modifica wikitesto]Adulto
- 0.3 mL IM in sol. acquosa al 1:1000 iniettabile; il range normale è 0,2-0,5 mL in 10-15 min. Potrebbe essere necessario ridurre la dose di ml 0,2 nelle persone anziane o con noti problemi cardiaci.
- dispositivo auto-iniettabile 0,33 mg (Fastieckt 0,33 mg)[144] prescrivibile in Fascia H.
Pediatrico
- IM di dosaggio nei bambini è in base al peso: 0,01 ml/kg IM di diluizione 1:1000, non superare 0,3 ml IM in diluizione 1:2000 in 10-15 min.
- dispositivo auto-iniettabile 0.165 mg (Fastieckt 0,165 mg)[157] prescrivibile in Fascia H.
Terapia farmacologica sintomatica
[modifica | modifica wikitesto]- Antistaminici: sono correntemente usati sia nella fase di mantenimento sia nelle fasi acute. Possono provocare sedazione, rischiosa in soggetti impegnati in attivita che richiedono vigilanza (ad esempio la guida), specie i preparati di vecchia generazione.
- Antileucotrienici: hanno indicazione nella manifestazioni allergiche polmonari, il loro uso nelle allergie alimentari è da considerare sperimentale[158].
- Steroidi: nella fase acuta delle manifestazioni allergiche. Sono in assoluto i farmaci più efficaci sui sintomi dell'allergia alimentare e in generale sull'infiammazione; ma sono gravati da importanti effetti collaterali sistemici specie nell'uso prolungato. Le posologie di questi farmaci sono variabili tra le varie molecole in funzione di un rapporto di equivalenza posologica esistente tra i vari steroidi; e soprattutto in funzione della gravità e dal tipo di manifestazione patologica.
- Cromoglicato di sodio o DSCG o Cromolyn: in pazienti con sintomi e segni gastrointestinali va usato nella fase di mantenimento a scopo profilattico per evitare o ridurre le eventuali recidive e la loro gravità,[159] ha la caratteristica di non essere assorbito per os, e di avere un'ottima tollerabilità.
Nella esofagite eosinofila[160] il sodio cromoglicato mostra una certa efficacia[161] [162] [163] [164] [165]. Inoltre, in bambini con dermatite atopica l'uso per os dello stesso è in grado di ridurre la permeabilità intestinale patologica alle macromolecole allergizzanti;[166] [167]; mentre è controverso, a tutt'oggi, l'uso per via topica[168] [169].
Il Sodio Cromoglicato o Cromolyn sodico per uso orale (sotto forma di fialoidi) negli USA è indicato nella mastocitosi sistemica, grave patologia rara, riuscendo in questa patologia a alleviare i sintomi gastrointestinali associati.
Immunoterapia
[modifica | modifica wikitesto]L'obiettivo della immunoterapia è di indurre la desensibilizzazione o la tolleranza all'allergene riducendo la sua capacità di attivare la produzione di IgE. I soggetti allergici sono desensibilizzati attraverso la somministrazione di dosi crescenti di allergene che diminuisce gradualmente la risposta IgE-mediata.
Varie ricerche hanno cercato di individuare il sistema più pratico e con minor incidenza di reazioni avverse per esporre il soggetto allergico a dosi crescenti di allergene. Le più esplorate sono[170]:
- immunoterpia sublinguale
- immunoterapia sottocutanea
- immunoterapia orale
L'immunoterapia specifica segue un approccio diametralmente opposto all'evitamento: è una immunoterapia, per l'allergia alimentare, che consiste nella esposizione a dosi crescenti dell'allergene e di un periodo di mantenimento, in modo da sviluppare una tolleranza o iposensitizzazione e da eliminare la reazione allergica. Per le allergie alimentari si può utilizzare come allergene l'alimento stesso a cui viene imputata l'allergia. Chiamata anche Desensibilizzazione Orale per Alimenti, con una dieta alimentare variata, bilanciata ed organizzata. L'assunzione avviene in ospedale e a domicilio, sotto stretto controllo medico, per alcuni mesi uno-due pasti a settimana adeguatamente intervallati, partendo da dosi molto piccole dell'allergene: i vari protocolli variano il periodo di dose crescente e di mantenimento a dose costante, da due settimane ad alcuni mesi. Ai pazienti selezionati può essere prescritto l'autoiniettore di epinefrina da utilizzare a domicilio in caso di reazione grave.
Maggiore rischio è presente nei pazienti con elevate IgE sieriche e altri fattori di rischio, come ricongiuntivite allergica e asma. Se mancano reazioni allergiche in condizioni normali, un secondo test viene effettuato per verificare l'assenza di reazioni in condizioni di stress, perché studi evidenziano reazioni anafilattiche (FDEIA) in pazienti che hanno effettuato sforzi fisici alcune ore dopo l'assunzione dell'alimento adoperato per la immunoterapia specifica[171][172].
Altre condizioni che possono aumentare la reattività dell'individuo sono infezioni, riacutizzarsi di allergie ai pollini, la concomitante assunzione di lipidi e alcuni farmaci[173].
Pur essendo considerata promettente, in assenza di studi che ne validino adeguatamente l'efficacia clinica e considerando il rischio di reazioni avverse, al 2014, la immunoterapia non è consigliata per le allergie alimentari[7][61][174].
Terapie sperimentali
[modifica | modifica wikitesto]Molte ricerche di nuove terapie per l'allergia alimentare sono nella fase degli studi preclinici e clinici[10], fra queste sono considerate promettenti:
- L'immunizzazione con DNA plasmidico (pDNA)[175]
- L'uso di probiotici come il Lactobacillus rhamnosus[176]
- L'immunoterapia con allergeni di Listeria monocytogenes uccisi da calore come adiuvanti, che inducono la produzione di IFN-c[177]
- La medicina tradizionale cinese[178]
.
Prognosi
[modifica | modifica wikitesto]- Sviluppo della tolleranza
- In generale, la maggior parte di lattanti e dei bambini diventano clinicamente tolleranti all'ipersensibilità alimentare. In particolare, la maggior parte delle allergie "maggiori" sono al: latte, uova, soia e grano. Le allergie alle arachidi, alle noci, al pesce e frutti di mare sono le più persistenti[179].
- Studi basati sulla popolazione generale, mostrano che l'85% dei bambini piccoli superano la loro allergia al latte o all'uovo all'età di età 3-5 anni[180].
- Tuttavia, studi recenti hanno segnalato una maggiore incidenza delle allergie alle uova e al latte; in questi soggetti solo il 50% circa dei pazienti supera a 8-12 anni il disturbo[181][182]; gli stessi bambini hanno, però, continuato a ridurre nel tempo le percentuali di incidenza della loro allergia durante adolescenza.
- Circa il 20% dei lattanti e dei bambini guariscono della loro allergia alle arachidi quando raggiungono un'età scolastica[182].
- I bambini con allergie alimentari non-IgE mediate come la proctocoliti e l'enterocolite tipicamente risolvono le loro allergie alimentari nei primi anni di vita[183].
- L'esofagite allergica eosinofila sembra essere un disturbo persistente[184].
- Prevenzione dagli allergeni: l'evitamento rigido dell'allergene è la misura terapeutica, strategicamente necessaria, per evitare reazioni allergiche. Tuttavia come l'evitamento rigido o come esposizioni accidentali alterino il corso naturale delle allergie alimentari rimane poco chiaro[185][186].
- La prevenzione della malattia atopica attraverso la dieta[186].
- Numerosi studi hanno valutato il ruolo della dieta materno-infantile sugli esiti della malattia atopica (Asma, dermatite atopica, allergia alimentare), in particolare grazie a studi su neonati a rischio sulla base storia di atopia familiare (almeno 1 parente di primo grado con una documentata malattia atopica). La maggior parte degli studi si sono concentrati sulla eliminazione di allergeni o su un ritardo nella loro introduzione nella fase di svezzamento. Tuttavia, le limitazioni nei disegni degli studi e il limitato numero di studi hanno minimizzato la capacità di trarre conclusioni certe, su una serie di possibili interventi.
Mancano prove certe che dimostrerebbero come l'evitamento di allergeni durante la gravidanza abbia un effetto protettivo; tuttavia, alcune evidenze sostengono che si ha una riduzione della dermatite atopica quando gli allergeni sono stati evitati dalla madre durante l'allattamento.
- Per i neonati a rischio, ma si è visto che l'allattamento esclusivo con latte materno per almeno 3 mesi protegge contro asma dei primi anni di vita. Negli studi di neonati a rischio che non sono stati allattati esclusivamente al seno per 4-6 mesi, evidenze deboli mostrano che l'utilizzo di specifiche formule a base di caseina parzialmente idrolizzata riescono a ridurre o ritardare il rischio di dermatite atopica rispetto all'alimentazione con latte vaccino intero; mentre le formule di latte a base di soia non sembrano offrire un vantaggio rispetto al più comune latte artificiale a base di latte vaccino intero.
- Nessuna prova convincente sostiene la necessità di uno svezzamento con alimenti nuovi dopo i 4-6 mesi di la vita.
- Una volta che la malattia allergica è diagnosticata, è necessaria l'eliminazione degli allergeni dalla dieta.
- Studi futuri chiariranno il ruolo della dieta di eliminazione nella prevenzione delle allergie alimentari.
Prevenzione
[modifica | modifica wikitesto]Svezzamento dal latte materno
[modifica | modifica wikitesto]L'allattamento al seno evita l'allergia alle proteine del latte vaccino fino allo svezzamento.
Le raccomandazioni dell'Organizzazione mondiale della sanità (OMS) suggeriscono di ritardare questa fase di diversificazione alimentare[187]; ritenendo che un'eventuale immaturità del sistema immunitario dei bambini, può essere causa di allergie in futuro. Non vi è, però, alcuna prova sperimentale che ciò sia in grado di ridurre i problemi delle allergie in età pediatrica[188]. Al contrario, modelli animali tendono a mostrare che l'esposizione precoce ad allergeni alimentari riesce ad indurre meglio la tolleranza orale e ridurre quindi il rischio di sviluppare allergie in età pediatrica[189]. Ciò sembra confermato anche da alcuni studi osservazionali[190].
Il problema, pertanto, della scelta tra lo svezzamento precoce o ritardato nel tempo resta a tutt'oggi irrisolto.
Prevenzione dalle reazioni ai vaccini
[modifica | modifica wikitesto]Vi sono dati scientifici che suggeriscono la somministrazione routinaria della dose unica di vaccino per il morbillo-parotite-rosolia a tutti i pazienti con allergia all'uovo, anche quelli con gravi reazioni anafilattiche dopo l'ingestione di uova[191].
Nel bambino con una storia precedente di reazione al vaccino morbillo-parotite-rosolia, va considerata la possibilità di un'allergia alla gelatina, neomicina, o un altro componente presente nel vaccino. Se il paziente ha una storia clinica di allergia all'uovo ed ha avuto reazioni sistemiche (ad esempio: anafilassi) in seguito all'ingestione di uovo, la somministrazione del vaccino dell'influenza necessita di speciali esami diagnostici[191].
Dopo aver esaminato i rischi e i benefici, la pelle del paziente può essere testata con preparati diluiti del vaccino influenzale (prove intradermiche cutanee). Se i risultati al test cutaneo con il vaccino diluito sono positivi, il vaccino può essere somministrato in modo graduato nel tempo, con un regime multidose; se viceversa il risultato della prova cutanea è negativo, il vaccino può essere somministrato in modo routinario con dose unica.
Linee guida
[modifica | modifica wikitesto]Le linee guida tra tutti i tipi di lavori scientifici prodotti danno: raccomandazioni di comportamento clinico; esse, infatti, sono prodotte con un processo di revisione sistematica periodica della conoscenza scientifica al fine di assistere clinici e pazienti, nei confronti delle problematiche valutate.
Le Linee Guida internazionali pubblicate al maggio 2010 sono: 43; di seguito alcune delle Linee Guida Internazionali più autorevoli e recenti in materia di:
- Allergie alimentari
- Food allergy: a practice parameter. 2006[192].
- Test diagnostici
- Work Group report: oral food challenge testing. 2009[193].
- Oral food challenge in children: an expert review. 2009[194].
- Skin testing with food allergens. Guideline of the German Society of Allergology and Clinical Immunology (DGAKI), the Physicians' Association of German Allergologists (ADA) and the Society of Pediatric Allergology (GPA) together with the Swiss Society of Allergology. 2008[195].
- Allergy diagnostic testing: an updated practice parameter. Part 2. 2008[148].
- Gastroenterologia
- Eosinophilic gastrointestinal diseases(EGIDs).[196]
- Dermatologia
- Vaccini
- Recommendations for administering the triple viral vaccine and anti-influenza vaccine in patients with egg allergy.[199].
- Svezzamento
- Food allergy and the introduction of solid foods to infants: a consensus document.[200]
- Prevenzione scolastica
- School guidelines for managing students with food allergies. 2006[201].
Normative
[modifica | modifica wikitesto]Aspetti medico-legali
[modifica | modifica wikitesto]- Quando si eseguono test di scatenamento orale, occorre essere sempre pronti nel riconoscere e trattare immediatamente gli eventuali sintomi clinici avversi.
- Il personale deve essere adeguatamente qualificato e si deve disporre delle attrezzature necessarie per il trattamento delle reazioni anafilattiche come lo shock. Queste devono essere disponibili durante tutta la durata della prova di scatenamento alimentare orale e durante il periodo di osservazione; per il rischio reale di innescare una reazione allergica.
- I pazienti non dovono mai essere istruiti ad eseguire autonomamente un test al proprio domicilio.
- Se il paziente ha una storia di reazioni allergiche gravi dopo l'ingestione di allergeni alimentari, va fornita una specifica consulenza sotto forma di un piano di emergenza scritto con i trattamenti del caso.
- Inoltre, il paziente va educato su come assumere farmaci di emergenza (ad esempio, adrenalina iniettabile, antistaminici, ecc) atto a gestire al meglio l'eventualità di una crisi anafilattica pericolosa per la vita del soggetto.
- Inoltre, se il caso esiste, vanno incoraggiati i pazienti a custodire e portare con i farmaci di emergenza sempre, in modo che in qualsiasi momento essi dovessero servire devono essere prontamente disponibili.

Informazione del soggetto allergico
[modifica | modifica wikitesto]L'evitamento del cibo allergenico è possibile solo se il soggetto allergico e chi ne ha cura sono informati della sua presenza. Molti stati hanno adottato norme che comportano l'obbligo di etichettatura nei cibi preconfezionati degli alimenti o ingredienti classificati come allergeni. Le norme si riferiscono a liste di cibi allergenici che possono variare da nazione a nazione, ma che quasi sempre includono gli 8 maggiori allergeni alimentari: latte, uovo, arachide, grano, soia, frutta con guscio, crostacei, pesci. Le norme sull'obbligo di comunicazione si riferiscono solo a alimenti o loro ingredienti allergenici, inseriti volontariamente nel prodotto. Per ridurre il rischio di allergeni occulti, l'industria alimentare da qualche anno ha introdotto il concetto di etichettatura precauzionale. Sul prodotto viene comunicato, a discrezione del produttore, che esiste il rischio di una presenza involontaria dei più comuni allergeni alimentari, dovuto in genere a contaminazione nei processi di produzione. La comunicazione precauzionale con frasi tipo:
- Può contenere (allergene e/o fonte dell'allergene).
- Può contenere tracce di (allergene e/o fonte dell'allergene).
- Prodotto in stabilimenti in cui viene utilizzato (allergene e/o fonte dell'allergene).
- Prodotto in filiere alimentari non separate, in cui viene processato anche (allergene e/o fonte dell'allergene).
se da una parte mostra l’intento benevolo di avvertire il consumatore allergico che quell’alimento potrebbe veicolare, per varie ragioni, tracce degli allergeni indicati, dall’altra produce un vero e proprio ribaltamento di responsabilità che passa dal produttore al consumatore[5].
Note
[modifica | modifica wikitesto]- ^ a b Rudolf Valenta, Heidrun Hochwallner, Birgit Linhart, Sandra Pahr, Food Allergies: The Basics, in Gastroenterology, 2015, pp. 1120-1131, DOI:10.1053/j.gastro.2015.02.006.
- ^ Alessandro Fiocchi, Lamia Dahdah, L’allergia alimentare: panoramica su una patologia sempre più diffusa e multiforme (PDF), in Rivista di Immunologia e Allergologia Pediatrica, vol. 02, 2013, pp. 15-20. URL consultato il 28 febbraio 2017 (archiviato dall'url originale il 3 settembre 2013).
- ^ a b c d e f g h i Boyce e al., Guidelines for the Diagnosis and Management of Food Allergy in the United States: Report of the NIAID-Sponsored Expert Panel (PDF), National Institute of Allergy and Infectious Diseases, 2012.
- ^ a b c d Direzione generale per l’igiene e la sicurezza degli alimenti e la nutrizione, Allergie alimentari e sicurezza del consumatore (PDF), Ministero della Sanità, 2014. URL consultato il 28 febbraio 2017 (archiviato dall'url originale il 14 febbraio 2017).
- ^ a b c d Marco Ciarrocchi, Concetta Boniglia, Stefania Giammarioli, Elisabetta Sanzini, Tutela dei consumatori affetti da allergie alimentari: presupposti e modalità di intervento (PDF), in Rapporti ISTISAN, Istituto Superiore di Sanità, 2011. URL consultato il 28 febbraio 2017 (archiviato dall'url originale il 28 febbraio 2017).
- ^ Johansson SG, Hourihane JO, Bousquet J, BruijnzeelKoomen C, Dreborg S, Haahtela T e al., A revised nomenclature for allergy. An EAACI position statement from the EAACI nomenclature task force., in Allergy, vol. 56, 2001, pp. 813-824.
- ^ a b c Regione toscana: consiglio sanitario regionale - Linee guida per la diagnosi e la cura delle allergopatie (PDF) (archiviato dall'url originale il 28 aprile 2017).
- ^ Società Italiana di Allergologia e Immunologia Pediatrica ‐ Associazione Allergologi Immunologi Territoriali e Ospedalieri ‐ Società di Allergologia, Asma e Immunologia Clinica, Allergie e Intolleranze Alimentari - Documento Condiviso (PDF). URL consultato il 28 febbraio 2017 (archiviato dall'url originale il 6 settembre 2016).
- ^ Linee guida EAACI, PREVALENCE OF COMMON FOOD ALLERGIES IN EUROPE, pp.22-45.
- ^ a b c d e f g h i j SH. Sicherer e HA. Sampson, Food allergy: Epidemiology, pathogenesis, diagnosis, and treatment., in J Allergy Clin Immunol, vol. 133, n. 2, Feb 2014, pp. 291–307; quiz 308, DOI:10.1016/j.jaci.2013.11.020, PMID 24388012.
- ^ Making sense of allergies (PDF), su senseaboutscience.org, Sense About Science, p. 1. URL consultato il 7 giugno 2015 (archiviato dall'url originale il 18 giugno 2015).
- ^ ER. Coon, RA. Quinonez, VA. Moyer e AR. Schroeder, Overdiagnosis: how our compulsion for diagnosis may be harming children., in Pediatrics, vol. 134, n. 5, Nov 2014, pp. 1013-23, DOI:10.1542/peds.2014-1778, PMID 25287462.
- ^ Sampson, Hugh A. e al., AGA technical review on the evaluation of food allergy in gastrointestinal disorders, in Gastroenterology, vol. 120, n. 4, pp. 1026-1040.
- ^ MI. Fogg, JM. Spergel, Management of food allergies., in Expert Opin Pharmacother, vol. 4, n. 7, luglio 2003, pp. 1025-37, DOI:10.1517/14656566.4.7.1025, PMID 12831331.
- ^ Linee guida EAACI.
- ^ Matthew Smith, Another Person's Poison: A History of Food Allergy, Columbia University Press, 2015
- ^ a b Linee guida EAACI, THE EPIDEMIOLOGY OF FOOD ALLERGY IN EUROPE, pp.3-22.
- ^ Rona, Roberto J. e al., The prevalence of food allergy: A meta-analysis, in Journal of Allergy and Clinical Immunology, vol. 120, n. 3, pp. 638-646.
- ^ CT. Ferreira e E. Seidman, Food allergy: a practical update from the gastroenterological viewpoint., in J Pediatr (Rio J), vol. 83, n. 1, pp. 7-20, DOI:10.2223/JPED.1587, PMID 17279290.
- ^ Opinione EFSA, Allergy to milk and dairy products, pp.72-82.
- ^ Opinione EFSA, Allergy to eggs, pp.82-91.
- ^ Opinione EFSA, Allergy to peanuts, pp-106-116.
- ^ Opinione EFSA, Allergy to soy, pp.107-117.
- ^ Opinione EFSA, Allergy to nuts, pp.91-106.
- ^ Opinione EFSA, Allergy to crustaceans, pp.136-145.
- ^ Opinione EFSA, Allergy to cereals containing gluten, pp.63-71.
- ^ Opinione EFSA, Allergy to fish, pp-127-136.
- ^ A. Martelli - Il registro delle allergie rare (PDF). URL consultato il 28 febbraio 2017 (archiviato dall'url originale il 28 febbraio 2017).
- ^ Opinione EFSA, Allergy to molluscus, pp.145-151.
- ^ Opinione EFSA, Allergy to celery, pp.151-156.
- ^ Opinione EFSA, Allergy to lupin, pp.156-161.
- ^ Opinione EFSA, Allergy to sesame, pp.162-167.
- ^ Opinione EFSA, Allergy to mustard, pp.167-173.
- ^ Products - Data Briefs - Number 10 - October 2008.
- ^ Rate of Childhood Peanut Allergies More than Tripled Between 1997 and 2008 - The Mount Sinai Hospital.
- ^ Opinione EFSA, Prevalence of allergy to foods not listed in Annex IIIa, pp.28-31.
- ^ a b Zuidmeer L, e al., The prevalence of plant food allergies: a systematic review., in J Allergy Clin Immunol, vol. 121, n. 5, 2008, pp. 1210-1218.
- ^ L. Cox, et al., American College of Allergy, Asthma and Immunology Test Task Force; American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force., Pearls and pitfalls of allergy diagnostic testing: report from the American College of Allergy, Asthma and Immunology/American Academy of Allergy, Asthma and Immunology Specific IgE Test Task Force., in Ann Allergy Asthma Immunol., vol. 101, n. 6, dicembre 2008, pp. 580-92, PMID 9119701.
- ^ R.F., Horan, Schneider, L.C., Sheffer, A.L., Allergic Disorders and Mastocytosis, in Journal of the American Medical Association, vol. 268, 1992, pp. 2858-68, PMID 1433701.
- ^ (EN) M. Osterballe, et al., The prevalence of food hypersensitivity in young adults, in Pediatr Allergy Immunol., vol. 20, n. 7, novembre 2009, pp. 686-92, PMID 19594854.
- ^ FDA: Approaches to Establish Thresholds for Major Food Allergens and for Gluten in Food.
- ^ AA, Anaphylaxis in Schools and Other Childcare Settings, in Journal of Allergy and Clinical Immunology., vol. 102, 1998, pp. 173-76, PMID 9723657.
- ^ a b Sampson HA, Mendelson L, Rosen JP, Fatal and near-fatal anaphylactic reactions to food in children and adolescents, in N. Engl. J. Med., vol. 327, n. 6, agosto 1992, pp. 380-4, PMID 1294076.
- ^ Allergie alimentari, boom tra più piccoli - Scienza e Medicina - ANSA.it.
- ^ Allergen Immunotherapy, su niaid.nih.gov, 22 aprile 2015. URL consultato il 15 giugno 2015 (archiviato dall'url originale il 9 settembre 2016).
- ^ Pumphrey RS, Gowland MH, Further fatal allergic reactions to food in the United Kingdom, 1999-2006, in J. Allergy Clin. Immunol., vol. 119, n. 4, aprile 2007, pp. 1018-9, DOI:10.1016/j.jaci.2007.01.021, PMID 17349682.
- ^ Bock SA, Muñoz-Furlong A, Sampson HA, Further fatalities caused by anaphylactic reactions to food, 2001-2006, in J. Allergy Clin. Immunol., vol. 119, n. 4, aprile 2007, pp. 1016-8, DOI:10.1016/j.jaci.2006.12.622, PMID 17306354.
- ^ a b c d J. Wang, HA. Sampson, Food allergy: recent advances in pathophysiology and treatment., in Allergy Asthma Immunol Res, vol. 1, n. 1, ottobre 2009, pp. 19-29, DOI:10.4168/aair.2009.1.1.19, PMID 20224666.
- ^ Bock SA, Muñoz-Furlong A, Sampson HA, Fatalities due to anaphylactic reactions to foods, in J. Allergy Clin. Immunol., vol. 107, n. 1, gennaio 2001, pp. 191-3, DOI:10.1067/mai.2001.112031, PMID 11150011.
- ^ C. Dantonio, M. Galimberti; B. Barbone; M. Calamari; G. Airoldi; M. Campanini; C. Di Pietrantonj; GC. Avanzi, Suspected acute allergic reactions: analysis of admissions to the Emergency Department of the AOU Maggiore della Carità Hospital in Novara from 2003 to 2007., in Eur Ann Allergy Clin Immunol, vol. 40, n. 4, dicembre 2008, pp. 122-9, PMID 19227647.
- ^ CW, Lee, Sheffer AL., Peanut allergy., in Allergy Asthma Proc., vol. 24, n. 4, Jul-Aug 2003, pp. 259-64, PMID 12974192.
- ^ T. Buie, et al.,, Evaluation, diagnosis, and treatment of gastrointestinal disorders in individuals with ASDs: a consensus report., in Pediatrics., vol. 125, Suppl 1, gennaio 2010, pp. S1-18, PMID 20048083.
- ^ HJ. Tsai, R. Kumar; J. Pongracic; X. Liu; R. Story; Y. Yu; D. Caruso; J. Costello; A. Schroeder; Y. Fang; H. Demirtas, Familial aggregation of food allergy and sensitization to food allergens: a family-based study., in Clin Exp Allergy, vol. 39, n. 1, gennaio 2009, pp. 101-9, DOI:10.1111/j.1365-2222.2008.03111.x, PMID 19016802.
- ^ G. Lack, D. Fox; K. Northstone; J. Golding, Factors associated with the development of peanut allergy in childhood., in N Engl J Med, vol. 348, n. 11, marzo 2003, pp. 977-85, DOI:10.1056/NEJMoa013536, PMID 12637607.
- ^ JO. Hourihane, TP. Dean; JO. Warner, Peanut allergy in relation to heredity, maternal diet, and other atopic diseases: results of a questionnaire survey, skin prick testing, and food challenges., in BMJ, vol. 313, n. 7056, agosto 1996, pp. 518-21, PMID 8789975.
- ^ SM. Tariq, M. Stevens; S. Matthews; S. Ridout; R. Twiselton; DW. Hide, Cohort study of peanut and tree nut sensitisation by age of 4 years., in BMJ, vol. 313, n. 7056, agosto 1996, pp. 514-7, PMID 8789974.
- ^ X. Liu, S. Zhang; HJ. Tsai; X. Hong; B. Wang; Y. Fang; X. Liu; JA. Pongracic; X. Wang, Genetic and environmental contributions to allergen sensitization in a Chinese twin study., in Clin Exp Allergy, vol. 39, n. 7, luglio 2009, pp. 991-8, DOI:10.1111/j.1365-2222.2009.03228.x, PMID 19302247.
- ^ SH. Sicherer, TJ. Furlong; HH. Maes; RJ. Desnick; HA. Sampson; BD. Gelb, Genetics of peanut allergy: a twin study., in J Allergy Clin Immunol, vol. 106, 1 Pt 1, luglio 2000, pp. 53-6, DOI:10.1067/mai.2000.108105, PMID 10887305.
- ^ Xiumei Hong, Hui-Ju Tsai,Xiaobin Wang, Genetics of Food allergy, in Curr Opin Pediatr., vol. 21, n. 6, 2009, pp. 770-776.
- ^ Xiumei Hong e al., Genome-wide association study identifies peanut allergy-specific loci and evidence of epigenetic mediation in US children, in Nature Communications, vol. 6, 2015.
- ^ a b c Hugh A. Sampson, Christopher Randolph e al., Food allergy: A practice parameter update—2014, in J ALLERGY CLIN IMMUNOL, American Academy of Allergy, Asthma & Immunology, 2014, DOI:10.1016/j.jaci.2014.05.013.
- ^ Spivey A., Molecular Biology: The Shape of Food Allergenicity., in Environmental Health Perspectives.anno=2005, vol. 113, n. 7.
- ^ FAO/WHO. Evaluation of Allergenicity of Genetically Modified Foods; Report of a Joint FAO/WHO Expert Consultation on Allergenicity of Foods Derived from Biotechnology; FAO/WHO: Rome, Italy, 2001; pp. 10–13[collegamento interrotto]
- ^ EFSA Panel on Genetically Modified Organisms (GMO Panel), Scientific Opinion on the assessment of allergenicity of GM plants and microorganisms and derived food and feed, in EFSA Journal, vol. 8, n. 1700, 2010, DOI:10.2903/j.efsa.2010.1700/epdf.
- ^ Katia Pauwels, Ruth Mampuys, Catherine Golstein, Didier Breyer, Philippe Herman, Marion Kaspari, Jean-Christophe Pagès, Herbert Pfister, Frank van der Wilk, Birgit Schönig, Risk assessment challenges of Synthetic Biology, in Journal für Verbraucherschutz und Lebensmittelsicherheit, vol. 8, n. 3, settembre 2013, pp. 215-226.
- ^ RW Weber, Food additives and allergy., in Ann Allergy., vol. 2, 70(3), Mar 1993, pp. 183-90, PMID 9554896.
- ^ Allergopharma: Cross-Reactive Allergens & Allergen Calendar.
- ^ Edoardo Chiesa, Alimenti allergizzanti e allergeni, su docplayer.it.
- ^ a b Garcìa BE., Lizaso MT., Cross-reactivity Syndromes in Food Allergy. (PDF), in J Investig Allergol Clin Immunol., vol. 21, n. 3, 2011, pp. 162-170.
- ^ Sander I, Raulf-Heimsoth M, Duser M, Flagge A, Czuppon AB, Baur X,, Differentiation between cosensitization and cross-reactivity in wheat flour and grass pollen-sensitized subjects, in Int Arch Allergy Immunol, vol. 112, 1997, pp. 378-385.
- ^ Jones SM, Magnolfi CF, Cooke SK, Sampson HA, Immunologic cross-reactivity among cereal grains and grasses in children with food hypersensitivity, in Journal of Allergy and Clinical Immunology, vol. 96, 1995, pp. 341-351.
- ^ Stefan Vieths, Stephan Scheurer,Barbara Ballmer-Weber, Current Understanding ofCross-Reactivity of Food Allergens and Pollen, in Ann. New York Academy of Sciences, vol. 964, 2002, pp. 47-68.
- ^ SH. Sicherer, HA. Sampson, 9. Food allergy., in J Allergy Clin Immunol, vol. 117, 2 Suppl Mini-Primer, febbraio 2006, pp. S470-5, DOI:10.1016/j.jaci.2005.05.048, PMID 16455349.
- ^ Sampson HA, Utility of food-specific IgE concentrations in predicting symptomatic food allergy, in J. Allergy Clin. Immunol., vol. 107, n. 5, maggio 2001, pp. 891-6, DOI:10.1067/mai.2001.114708, PMID 11344358.
- ^ P. Vadas, M. Gold; B. Perelman; GM. Liss; G. Lack; T. Blyth; FE. Simons; KJ. Simons; D. Cass; J. Yeung, Platelet-activating factor, PAF acetylhydrolase, and severe anaphylaxis., in N Engl J Med, vol. 358, n. 1, gennaio 2008, pp. 28-35, DOI:10.1056/NEJMoa070030, PMID 18172172.
- ^ C. Incorvaia, M. Mauro; V. Pravettoni; S. Incorvaia; GG. Riario-Sforza, Anaphylaxis: an update on its understanding and management., in Recent Pat Inflamm Allergy Drug Discov, vol. 4, n. 2, giugno 2010, pp. 124-9, PMID 20100165.
- ^ K. Arias, M. Baig; M. Colangelo; D. Chu; T. Walker; S. Goncharova; A. Coyle; P. Vadas; S. Waserman; M. Jordana, Concurrent blockade of platelet-activating factor and histamine prevents life-threatening peanut-induced anaphylactic reactions., in J Allergy Clin Immunol, vol. 124, n. 2, agosto 2009, pp. 307-14, 314.e1-2, DOI:10.1016/j.jaci.2009.03.012, PMID 19409603.
- ^ AW. Burks, Factoring PAF in anaphylaxis., in N Engl J Med, vol. 358, n. 1, gennaio 2008, pp. 79-81, DOI:10.1056/NEJMe078159, PMID 18172180.
- ^ (EN) Steckelbroeck S, Ballmer-Weber BK,Vieths S. 2008. Potential, pitfalls, and prospects of food allergy diagnostics using recombinant allergens or synthetic sequential epitopes. J. Allergy Clin. Immunol. 121:1323–30. PMID 18472149
- ^ Cabanillas B, Pedrosa MM, Rodríguez J, González A, Muzquiz M, Cuadrado C,Crespo JF, Burbano C. Effects of enzymatic hydrolysis on lentil allergenicity.Mol Nutr Food Res. 2010 Mar 19. [Epub ahead of print] PMID 20306474.
- ^ López-Expósito I, Chicón R, Belloque J, Recio I, Alonso E, López-Fandiño R. Changes in the ovalbumin proteolysis profile by high pressure and its effect on IgG and IgE binding. J Agric Food Chem. 2008 Dec 24;56(24):11809-16. PMID 19053365.
- ^ Chicón R, Belloque J, Alonso E, Martín-Alvarez PJ, López-Fandiño R. Hydrolysis under high hydrostatic pressure as a means to reduce the binding of beta-lactoglobulin to immunoglobulin E from human sera. J Food Prot. 2008 Jul;71(7):1453-9. PMID 18680946.
- ^ SN. Merwat, SJ. Spechler, Might the use of acid-suppressive medications predispose to the development of eosinophilic esophagitis?, in Am J Gastroenterol, vol. 104, n. 8, agosto 2009, pp. 1897-902, DOI:10.1038/ajg.2009.87, PMID 19661930.
- ^ M. Bohm, JE. Richter; S. Kelsen; R. Thomas, Esophageal dilation: simple and effective treatment for adults with eosinophilic esophagitis and esophageal rings and narrowing., in Dis Esophagus, marzo 2010, DOI:10.1111/j.1442-2050.2010.01051.x, PMID 20353444.
- ^ J. Molina-Infante, J. Zamorano, Acid-suppressive therapy and eosinophilic esophagitis: friends or foes?, in Am J Gastroenterol, vol. 105, n. 3, marzo 2010, pp. 699-700, DOI:10.1038/ajg.2009.590, PMID 20203650.
- ^ R. Fass, A. Gasiorowska, Refractory GERD: what is it?, in Curr Gastroenterol Rep, vol. 10, n. 3, giugno 2008, pp. 252-7, PMID 18625135.
- ^ SP. Pentiuk, CK. Miller; A. Kaul, Eosinophilic esophagitis in infants and toddlers., in Dysphagia, vol. 22, n. 1, gennaio 2007, pp. 44-8, DOI:10.1007/s00455-006-9040-9, PMID 17024545.
- ^ S. Baxi, SK. Gupta; N. Swigonski; JF. Fitzgerald, Clinical presentation of patients with eosinophilic inflammation of the esophagus., in Gastrointest Endosc, vol. 64, n. 4, ottobre 2006, pp. 473-8, DOI:10.1016/j.gie.2006.03.931, PMID 16996334.
- ^ EE. Forbes, K. Groschwitz; JP. Abonia; EB. Brandt; E. Cohen; C. Blanchard; R. Ahrens; L. Seidu; A. McKenzie; R. Strait; FD. Finkelman, IL-9- and mast cell-mediated intestinal permeability predisposes to oral antigen hypersensitivity., in J Exp Med, vol. 205, n. 4, aprile 2008, pp. 897-913, DOI:10.1084/jem.20071046, PMID 18378796.
- ^ J. Louahed, Y. Zhou; WL. Maloy; PU. Rani; C. Weiss; Y. Tomer; A. Vink; J. Renauld; J. Van Snick; NC. Nicolaides; RC. Levitt, Interleukin 9 promotes influx and local maturation of eosinophils., in Blood, vol. 97, n. 4, febbraio 2001, pp. 1035-42, PMID 11159534.
- ^ M. Heyman, JF. Desjeux, Cytokine-induced alteration of the epithelial barrier to food antigens in disease., in Ann N Y Acad Sci, vol. 915, 2000, pp. 304-11, PMID 11193593.
- ^ KR. Groschwitz, SP. Hogan, Intestinal barrier function: molecular regulation and disease pathogenesis., in J Allergy Clin Immunol, vol. 124, n. 1, luglio 2009, pp. 3-20; quiz 21-2, DOI:10.1016/j.jaci.2009.05.038, PMID 19560575.
- ^ a b MT. Ventura, L. Polimeno; AC. Amoruso; F. Gatti; E. Annoscia; M. Marinaro; E. Di Leo; MG. Matino; R. Buquicchio; S. Bonini; A. Tursi, Intestinal permeability in patients with adverse reactions to food., in Dig Liver Dis, vol. 38, n. 10, ottobre 2006, pp. 732-6, DOI:10.1016/j.dld.2006.06.012, PMID 16880015.
- ^ a b c M. Heyman, Gut barrier dysfunction in food allergy., in Eur J Gastroenterol Hepatol, vol. 17, n. 12, dicembre 2005, pp. 1279-85, PMID 16292078.
- ^ A. Fasano, T. Shea-Donohue, Mechanisms of disease: the role of intestinal barrier function in the pathogenesis of gastrointestinal autoimmune diseases., in Nat Clin Pract Gastroenterol Hepatol, vol. 2, n. 9, settembre 2005, pp. 416-22, DOI:10.1038/ncpgasthep0259, PMID 16265432.
- ^ D. Hollander, Permeability in Crohn's disease: altered barrier functions in healthy relatives?, in Gastroenterology, vol. 104, n. 6, giugno 1993, pp. 1848-51, PMID 8500744.
- ^ M. Peeters, B. Geypens; D. Claus; H. Nevens; Y. Ghoos; G. Verbeke; F. Baert; S. Vermeire; R. Vlietinck; P. Rutgeerts, Clustering of increased small intestinal permeability in families with Crohn's disease., in Gastroenterology, vol. 113, n. 3, settembre 1997, pp. 802-7, PMID 9287971.
- ^ SM. Edelman, DL. Kasper, Symbiotic commensal bacteria direct maturation of the host immune system., in Curr Opin Gastroenterol, vol. 24, n. 6, novembre 2008, pp. 720-4, DOI:10.1097/MOG.0b013e32830c4355, PMID 19122522.
- ^ K. Takahashi, Interaction between the intestinal immune system and commensal bacteria and its effect on the regulation of allergic reactions., in Biosci Biotechnol Biochem, vol. 74, n. 4, 2010, pp. 691-5, PMID 20378987.
- ^ RJ. Fecek, M. Marcondes Rezende; R. Busch; I. Hassing; R. Pieters; CF. Cuff, Enteric reovirus infection stimulates peanut-specific IgG2a responses in a mouse food allergy model., in Immunobiology, marzo 2010, DOI:10.1016/j.imbio.2010.02.004, PMID 20356650.
- ^ GT. Rijkers, S. Bengmark; P. Enck; D. Haller; U. Herz; M. Kalliomaki; S. Kudo; I. Lenoir-Wijnkoop; A. Mercenier; E. Myllyluoma; S. Rabot, Guidance for substantiating the evidence for beneficial effects of probiotics: current status and recommendations for future research., in J Nutr, vol. 140, n. 3, marzo 2010, pp. 671S-6S, DOI:10.3945/jn.109.113779, PMID 20130080.
- ^ E. Isolauri, S. Salminen, Probiotics: use in allergic disorders: a Nutrition, Allergy, Mucosal Immunology, and Intestinal Microbiota (NAMI) Research Group Report., in J Clin Gastroenterol, 42 Suppl 2, luglio 2008, pp. S91-6, DOI:10.1097/MCG.0b013e3181639a98, PMID 18542035.
- ^ a b SH. Sicherer, HA. Sampson, Food allergy: recent advances in pathophysiology and treatment. (PDF), in Annu Rev Med, vol. 60, 2009, pp. 261-77, DOI:10.1146/annurev.med.60.042407.205711, PMID 18729729 (archiviato dall'url originale il 24 dicembre 2016).
- ^ WG. Shreffler, RR. Castro; ZY. Kucuk; Z. Charlop-Powers; G. Grishina; S. Yoo; AW. Burks; HA. Sampson, The major glycoprotein allergen from Arachis hypogaea, Ara h 1, is a ligand of dendritic cell-specific ICAM-grabbing nonintegrin and acts as a Th2 adjuvant in vitro., in J Immunol, vol. 177, n. 6, settembre 2006, pp. 3677-85, PMID 16951327.
- ^ M. Chehade, L. Mayer, Oral tolerance and its relation to food hypersensitivities., in J Allergy Clin Immunol, vol. 115, n. 1, gennaio 2005, pp. 3-12; quiz 13, DOI:10.1016/j.jaci.2004.11.008, PMID 15637539.
- ^ M. Heyman, Symposium on 'dietary influences on mucosal immunity'. How dietary antigens access the mucosal immune system., in Proc Nutr Soc, vol. 60, n. 4, novembre 2001, pp. 419-26, PMID 12069393.
- ^ M. Heyman, E. Grasset; R. Ducroc; JF. Desjeux, Antigen absorption by the jejunal epithelium of children with cow's milk allergy., in Pediatr Res, vol. 24, n. 2, agosto 1988, pp. 197-202, PMID 3186332.
- ^ LT. Weaver, MF. Laker; R. Nelson, Enhanced intestinal permeability in preterm babies with bloody stools., in Arch Dis Child, vol. 59, n. 3, marzo 1984, pp. 280-1, PMID 6424585.
- ^ G. Du Toit, Y. Katz; P. Sasieni; D. Mesher; SJ. Maleki; HR. Fisher; AT. Fox; V. Turcanu; T. Amir; G. Zadik-Mnuhin; A. Cohen, Early consumption of peanuts in infancy is associated with a low prevalence of peanut allergy., in J Allergy Clin Immunol, vol. 122, n. 5, novembre 2008, pp. 984-91, DOI:10.1016/j.jaci.2008.08.039, PMID 19000582.
- ^ a b G. Vighi, F. Marcucci; L. Sensi; G. Di Cara; F. Frati, Allergy and the gastrointestinal system., in Clin Exp Immunol, 153 Suppl 1, settembre 2008, pp. 3-6, DOI:10.1111/j.1365-2249.2008.03713.x, PMID 18721321.
- ^ Y. Suzuki, C. Ra, Analysis of the mechanism for the development of allergic skin inflammation and the application for its treatment: aspirin modulation of IgE-dependent mast cell activation: role of aspirin-induced exacerbation of immediate allergy., in J Pharmacol Sci, vol. 110, n. 3, luglio 2009, pp. 237-44, PMID 19609060.
- ^ GS. Choi, JH. Kim; HN. Lee; JM. Sung; JW. Lee; HS. Park, Occupational asthma caused by inhalation of bovine serum albumin powder., in Allergy Asthma Immunol Res, vol. 1, n. 1, ottobre 2009, pp. 45-7, DOI:10.4168/aair.2009.1.1.45, PMID 20224670.
- ^ JA. Bird, AW. Burks, Food allergy and asthma., in Prim Care Respir J, vol. 18, n. 4, dicembre 2009, pp. 258-65, DOI:10.4104/pcrj.2009.00036, PMID 19588055.
- ^ IA. Penttila, MF. Zhang; E. Bates; G. Regester; LC. Read; H. Zola, Immune modulation in suckling rat pups by a growth factor extract derived from milk whey., in J Dairy Res, vol. 68, n. 4, novembre 2001, pp. 587-99, PMID 11928955.
- ^ TR. Torgerson, A. Linane; N. Moes; S. Anover; V. Mateo; F. Rieux-Laucat; O. Hermine; S. Vijay; E. Gambineri; N. Cerf-Bensussan; A. Fischer, Severe food allergy as a variant of IPEX syndrome caused by a deletion in a noncoding region of the FOXP3 gene., in Gastroenterology, vol. 132, n. 5, maggio 2007, pp. 1705-17, DOI:10.1053/j.gastro.2007.02.044, PMID 17484868.
- ^ CR. Cardoso, PR. Provinciatto; DF. Godoi; BR. Ferreira; G. Teixeira; MA. Rossi; FQ. Cunha; JS. Silva, IL-4 regulates susceptibility to intestinal inflammation in murine food allergy., in Am J Physiol Gastrointest Liver Physiol, vol. 296, n. 3, marzo 2009, pp. G593-600, DOI:10.1152/ajpgi.90431.2008, PMID 19136382.
- ^ G. Lack, Epidemiologic risks for food allergy., in J Allergy Clin Immunol, vol. 121, n. 6, giugno 2008, pp. 1331-6, DOI:10.1016/j.jaci.2008.04.032, PMID 18539191.
- ^ LA. Lee, AW. Burks, Food allergies: prevalence, molecular characterization, and treatment/prevention strategies., in Annu Rev Nutr, vol. 26, 2006, pp. 539-65, DOI:10.1146/annurev.nutr.26.061505.111211, PMID 16602930.
- ^ BM. Yan, EA. Shaffer, Primary eosinophilic disorders of the gastrointestinal tract., in Gut, vol. 58, n. 5, maggio 2009, pp. 721-32, DOI:10.1136/gut.2008.165894, PMID 19052023.
- ^ HC. Gray, TM. Foy; BA. Becker; AP. Knutsen, Rice-induced enterocolitis in an infant: TH1/TH2 cellular hypersensitivity and absent IgE reactivity., in Ann Allergy Asthma Immunol, vol. 93, n. 6, dicembre 2004, pp. 601-5, PMID 15609772.
- ^ N. Benlounes, C. Candalh; P. Matarazzo; C. Dupont; M. Heyman, The time-course of milk antigen-induced TNF-alpha secretion differs according to the clinical symptoms in children with cow's milk allergy., in J Allergy Clin Immunol, vol. 104, 4 Pt 1, ottobre 1999, pp. 863-9, PMID 10518834.
- ^ HL. Chung, JB. Hwang; JJ. Park; SG. Kim, Expression of transforming growth factor beta1, transforming growth factor type I and II receptors, and TNF-alpha in the mucosa of the small intestine in infants with food protein-induced enterocolitis syndrome., in J Allergy Clin Immunol, vol. 109, n. 1, gennaio 2002, pp. 150-4, PMID 11799382.
- ^ KJ. Abernathy-Carver, HA. Sampson; LJ. Picker; DY. Leung, Milk-induced eczema is associated with the expansion of T cells expressing cutaneous lymphocyte antigen., in J Clin Invest, vol. 95, n. 2, febbraio 1995, pp. 913-8, DOI:10.1172/JCI117743, PMID 7532192.
- ^ R. Rokaite, L. Labanauskas, Gastrointestinal disorders in children with atopic dermatitis., in Medicina (Kaunas), vol. 41, n. 10, 2005, pp. 837-45, PMID 16272830.
- ^ CR. Cardoso, PR. Provinciatto; DF. Godoi; TS. Vieira; BR. Ferreira; G. Teixeira; MA. Rossi; FQ. Cunha; JS. Silva, B cells are involved in the modulation of pathogenic gut immune response in food-allergic enteropathy., in Clin Exp Immunol, vol. 154, n. 2, novembre 2008, pp. 153-61, DOI:10.1111/j.1365-2249.2008.03748.x, PMID 18778361.
- ^ A. Vojdani, Detection of IgE, IgG, IgA and IgM antibodies against raw and processed food antigens., in Nutr Metab (Lond), vol. 6, 2009, p. 22, DOI:10.1186/1743-7075-6-22, PMID 19435515.
- ^ KR. Groschwitz, R. Ahrens; H. Osterfeld; MF. Gurish; X. Han; M. Abrink; FD. Finkelman; G. Pejler; SP. Hogan, Mast cells regulate homeostatic intestinal epithelial migration and barrier function by a chymase/Mcpt4-dependent mechanism., in Proc Natl Acad Sci U S A, vol. 106, n. 52, dicembre 2009, pp. 22381-6, DOI:10.1073/pnas.0906372106, PMID 20018751.
- ^ Y. Kondo, A. Urisu, Oral allergy syndrome., in Allergol Int, vol. 58, n. 4, dicembre 2009, pp. 485-91, DOI:10.2332/allergolint.09-RAI-0136, PMID 19847095.
- ^ S. Khaldi, G. Gargala; L. Le Goff; S. Parey; A. Francois; J. Fioramonti; JJ. Ballet; JP. Dupont; P. Ducrotté; L. Favennec, Cryptosporidium parvum isolate-dependent postinfectious jejunal hypersensitivity and mast cell accumulation in an immunocompetent rat model., in Infect Immun, vol. 77, n. 11, novembre 2009, pp. 5163-9, DOI:10.1128/IAI.00220-09, PMID 19687199.
- ^ Chen YH, Wu HJ, Tsai JJ, Lee MF. Anaphylactic shock caused by a 33-kDa alpha S1-casein-like allergen in kingfish caviar. J Investig Allergol Clin Immunol.2009;19(3):245-6. PMID 19610275.
- ^ Pertierra Cortada A, Cambra Lasaosa FJ, Caritg Bosch J, Palomeque Rico A, Plaza Martín AM. [Shock and digestive symptoms in a neonate: a severe presentation of allergy to cow's milk proteins]. An Pediatr (Barc). 2006 Apr;64(4):392-3. Spanish. PMID 16606579.
- ^ Khodoun M, Strait R, Orekov T, Hogan S, Karasuyama H, Herbert DR, Köhl J, Finkelman FD. Peanuts can contribute to anaphylactic shock by activating complement. J Allergy Clin Immunol. 2009 Feb;123(2):342-51. Epub 2009 Jan 3. PMID 19121857
- ^ BW Robinson, Henoch-Schonlein purpura due to food sensitivity., in Br Med J., vol. 19, n. 1, febbraio 1977, pp. 510-11, PMID 556968.
- ^ M Arvonen, Ikni L, Augustin M, Karttunen TJ, Vähäsalo P, Increase of duodenal and ileal mucosal cytotoxic lymphocytes in juvenile idiopathic arthritis, in Clin Exp Rheumatol, vol. 1, n. 28, Jan-Feb 2010, pp. 128-34.
- ^ J Kokkonen, Arvonen M, Vähäsalo P, Karttunen TJ, Intestinal immune activation in juvenile idiopathic arthritis and connective tissue disease, in Scand J Rheumatol, vol. 5, n. 36, Sep-Oct 2007, pp. 386-9.
- ^ CC. Victorino, AH. Gauthier, The social determinants of child health: variations across health outcomes - a population-based cross-sectional analysis., in BMC Pediatr, vol. 9, 2009, p. 53, DOI:10.1186/1471-2431-9-53, PMID 19686599.
- ^ N. Speight, Best practice: migraine., in Arch Dis Child, vol. 91, n. 6, giugno 2006, p. 541, PMID 16714736.
- ^ J. Merrett, RC. Peatfield; FC. Rose; TG. Merrett, Food related antibodies in headache patients., in J Neurol Neurosurg Psychiatry, vol. 46, n. 8, agosto 1983, pp. 738-42, PMID 6886717.
- ^ a b TT. Postolache, H. Komarow; LH. Tonelli, Allergy: a risk factor for suicide?, in Curr Treat Options Neurol, vol. 10, n. 5, settembre 2008, pp. 363-76, PMID 18782509.
- ^ M. Esperanca, JW. Gerrard, Nocturnal enuresis: comparison of the effect of imipramine and dietary restriction on bladder capacity., in Can Med Assoc J, vol. 101, n. 12, dicembre 1969, pp. 65-8, PMID 5362303.
- ^ M. Abdel-Hafez, M. Shimada; PY. Lee; RJ. Johnson; EH. Garin, Idiopathic nephrotic syndrome and atopy: is there a common link?, in Am J Kidney Dis, vol. 54, n. 5, novembre 2009, pp. 945-53, DOI:10.1053/j.ajkd.2009.03.019, PMID 19556042.
- ^ JS. de Sousa, FC. Rosa; A. Baptista; H. Fonseca; G. Sá, Cow's milk protein sensitivity: a possible cause of nephrotic syndrome in early infancy., in J Pediatr Gastroenterol Nutr, vol. 21, n. 2, agosto 1995, pp. 235-7, PMID 7472914.
- ^ C. Cingi, D. Demirbas; M. Songu, Allergic rhinitis caused by food allergies., in Eur Arch Otorhinolaryngol, maggio 2010, DOI:10.1007/s00405-010-1280-5, PMID 20490817.
- ^ a b c d e Esami allergologici, su medicinaeprevenzione.paginemediche.it. URL consultato il 4 luglio 2010 (archiviato dall'url originale il 30 novembre 2012).
- ^ JM. Spergel, T. Brown-Whitehorn; JL. Beausoleil; M. Shuker; CA. Liacouras, Predictive values for skin prick test and atopy patch test for eosinophilic esophagitis., in J Allergy Clin Immunol, vol. 119, n. 2, febbraio 2007, pp. 509-11, DOI:10.1016/j.jaci.2006.11.016, PMID 17291865.
- ^ MI. Fogg, TA. Brown-Whitehorn; NA. Pawlowski; JM. Spergel, Atopy patch test for the diagnosis of food protein-induced enterocolitis syndrome., in Pediatr Allergy Immunol, vol. 17, n. 5, agosto 2006, pp. 351-5, DOI:10.1111/j.1399-3038.2006.00418.x, PMID 16846453.
- ^ A. Mehl, C. Rolinck-Werninghaus; U. Staden; A. Verstege; U. Wahn; K. Beyer; B. Niggemann, The atopy patch test in the diagnostic workup of suspected food-related symptoms in children., in J Allergy Clin Immunol, vol. 118, n. 4, ottobre 2006, pp. 923-9, DOI:10.1016/j.jaci.2006.07.003, PMID 17030247.
- ^ a b IL. Bernstein, JT. Li; DI. Bernstein; R. Hamilton; SL. Spector; R. Tan; S. Sicherer; DB. Golden; DA. Khan; RA. Nicklas; JM. Portnoy, Allergy diagnostic testing: an updated practice parameter., in Ann Allergy Asthma Immunol, vol. 100, 3 Suppl 3, marzo 2008, pp. S1-148, PMID 18431959.
- ^ Linee guida EAACI, THE DIAGNOSIS OF FOOD ALLERGY, pp.46-55.
- ^ T. Sarratud, S. Donnanno; L. Terracciano; G. Trimarco; A. Martelli; CJ. Petersson; MP. Borres; A. Fiocchi; G. Cavagni, Accuracy of a point-of-care testing device in children with suspected respiratory allergy., in Allergy Asthma Proc, vol. 31, n. 2, marzo 2010, pp. e11-7, DOI:10.2500/aap.2010.31.3323, PMID 20236576.
- ^ PA. Eigenmann, M. Kuenzli; V. D'Apuzzo; R. Kehrt; W. Joerg; M. Reinhardt; M. Rudengren; MP. Borres; RP. Lauener, The ImmunoCAP Rapid Wheeze/Rhinitis Child test is useful in the initial allergy diagnosis of children with respiratory symptoms., in Pediatr Allergy Immunol, vol. 20, n. 8, dicembre 2009, pp. 772-9, DOI:10.1111/j.1399-3038.2009.00866.x, PMID 19549098.
- ^ AJ. Cummings, RC. Knibb; RM. King; JS. Lucas, The psychosocial impact of food allergy and food hypersensitivity in children, adolescents and their families: a review., in Allergy, febbraio 2010, DOI:10.1111/j.1398-9995.2010.02342.x, PMID 20180792.
- ^ R. Lind, GA. Lied; K. Lillestøl; J. Valeur; A. Berstad, Do psychological factors predict symptom severity in patients with subjective food hypersensitivity?, in Scand J Gastroenterol, maggio 2010, DOI:10.3109/00365521003797213, PMID 20433401.
- ^ SB. Patten, JV. Williams, Self-reported allergies and their relationship to several Axis I disorders in a community sample., in Int J Psychiatry Med, vol. 37, n. 1, 2007, pp. 11-22, PMID 17645194.
- ^ K. Lillestøl, A. Berstad; R. Lind; E. Florvaag; G. Arslan Lied; T. Tangen, Anxiety and depression in patients with self-reported food hypersensitivity., in Gen Hosp Psychiatry, vol. 32, n. 1, pp. 42-8, DOI:10.1016/j.genhosppsych.2009.08.006, PMID 20114127.
- ^ LJ. Herbert, LM. Dahlquist, Perceived history of anaphylaxis and parental overprotection, autonomy, anxiety, and depression in food allergic young adults., in J Clin Psychol Med Settings, vol. 15, n. 4, dicembre 2008, pp. 261-9, DOI:10.1007/s10880-008-9130-y, PMID 19104982.
- ^ Fastjekt&Reg.
- ^ AR. Gupte, PV. Draganov, Eosinophilic esophagitis., in World J Gastroenterol, vol. 15, n. 1, gennaio 2009, pp. 17-24, PMID 19115464.
- ^ G. Patriarca, D. Schiavino; V. Pecora; C. Lombardo; E. Pollastrini; A. Aruanno; V. Sabato; A. Colagiovanni; A. Rizzi; T. De Pasquale; C. Roncallo, Food allergy and food intolerance: diagnosis and treatment., in Intern Emerg Med, vol. 4, n. 1, febbraio 2009, pp. 11-24, DOI:10.1007/s11739-008-0183-6, PMID 18709496.
- ^ CA. Liacouras, E. Ruchelli, Eosinophilic esophagitis., in Curr Opin Pediatr, vol. 16, n. 5, ottobre 2004, pp. 560-6, PMID 15367851.
- ^ J. Martín de Carpi, M. Gómez Chiari; E. Castejón Ponce; ML. Masiques Mas; P. Vilar Escrigas; V. Varea Calderón, [Increasing diagnosis of eosinophilic esophagitis in Spain], in An Pediatr (Barc), vol. 62, n. 4, aprile 2005, pp. 333-9, PMID 15826562.
- ^ A. Pérez-Millán, JL. Martín-Lorente; A. López-Morante; L. Yuguero; F. Sáez-Royuela, Subserosal eosinophilic gastroenteritis treated efficaciously with sodium cromoglycate., in Dig Dis Sci, vol. 42, n. 2, febbraio 1997, pp. 342-4, PMID 9052516.
- ^ RJ. Moots, P. Prouse; JM. Gumpel, Near fatal eosinophilic gastroenteritis responding to oral sodium chromoglycate., in Gut, vol. 29, n. 9, settembre 1988, pp. 1282-5, PMID 3143628.
- ^ J. Suzuki, Y. Kawasaki; R. Nozawa; M. Isome; S. Suzuki; A. Takahashi; H. Suzuki, Oral disodium cromoglycate and ketotifen for a patient with eosinophilic gastroenteritis, food allergy and protein-losing enteropathy., in Asian Pac J Allergy Immunol, vol. 21, n. 3, settembre 2003, pp. 193-7, PMID 15032404.
- ^ RG. Van Dellen, JC. Lewis, Oral administration of cromolyn in a patient with protein-losing enteropathy, food allergy, and eosinophilic gastroenteritis., in Mayo Clin Proc, vol. 69, n. 5, maggio 1994, pp. 441-4, PMID 8170195.
- ^ A. Ventura, L. De Seta; S. Martelossi; P. Florean; G. Maggiore; CM. Salvatore; M. Berzioli; G. Guidobaldi; G. Lorenzini; P. Peressini; P. Pesenti, Soy allergy and DSCG in atopic eczema: "much ado about nothing"?, in Pediatr Med Chir, vol. 18, n. 3, pp. 283-8, PMID 8858643.
- ^ R. Lindskov, L. Knudsen, Oral disodium cromoglycate treatment of atopic dermatitis., in Allergy, vol. 38, n. 3, aprile 1983, pp. 161-5, PMID 6405650.
- ^ C. Moore, MS. Ehlayel; J. Junprasert; RU. Sorensen, Topical sodium cromoglycate in the treatment of moderate-to-severe atopic dermatitis., in Ann Allergy Asthma Immunol, vol. 81, 5 Pt 1, novembre 1998, pp. 452-8, PMID 9860040.
- ^ M. Ariyanayagam, TJ. Barlow; P. Graham; SP. Hall-Smith; JM. Harris, Topical sodium cromoglycate in the management of atopic eczema--a controlled trial., in Br J Dermatol, vol. 112, n. 3, marzo 1985, pp. 343-8, PMID 3919754.
- ^ Linee guida EAACI, LONG-TERM MANAGEMENT STRATEGIES, p.66.
- ^ Exercise-induced anaphylaxis caused by wheat during specific oral intolerance induction, Calvani M., Miceli Sapo S., in Ann Allergy Asthma Immunol 2007;98(1):98-9
- ^ Food-exercise-induced anaphylaxis in a boy successfully desensitized to cow milk, Allergy 2007; 62: 335-6
- ^ Specific oral tolerance induction in food allwergy in children: efficacy and clinical patterns of reaction, Stader U.et al, Allergy 2007;62:1261-9
- ^ Linee guida EAACI, DIAGNOSIS AND MANAGEMENT OF FOOD ALLERGY, pp. 73-103.
- ^ X. Li, CK. Huang; BH. Schofield; AW. Burks; GA. Bannon; KH. Kim; SK. Huang; HA. Sampson, Strain-dependent induction of allergic sensitization caused by peanut allergen DNA immunization in mice., in J Immunol, vol. 162, n. 5, marzo 1999, pp. 3045-52, PMID 10072557.
- ^ H. Majamaa, E. Isolauri, Probiotics: a novel approach in the management of food allergy., in J Allergy Clin Immunol, vol. 99, n. 2, febbraio 1997, pp. 179-85, PMID 9042042.
- ^ OL. Frick, SS. Teuber; BB. Buchanan; S. Morigasaki; DT. Umetsu, Allergen immunotherapy with heat-killed Listeria monocytogenes alleviates peanut and food-induced anaphylaxis in dogs., in Allergy, vol. 60, n. 2, febbraio 2005, pp. 243-50, DOI:10.1111/j.1398-9995.2004.00711.x, PMID 15647048.
- ^ XM. Li, TF. Zhang; CK. Huang; K. Srivastava; AA. Teper; L. Zhang; BH. Schofield; HA. Sampson, Food Allergy Herbal Formula-1 (FAHF-1) blocks peanut-induced anaphylaxis in a murine model., in J Allergy Clin Immunol, vol. 108, n. 4, ottobre 2001, pp. 639-46, DOI:10.1067/mai.2001.118787, PMID 11590394.
- ^ RA. Wood, The natural history of food allergy., in Pediatrics, vol. 111, 6 Pt 3, giugno 2003, pp. 1631-7, PMID 12777603.
- ^ JM. Skripak, EC. Matsui; K. Mudd; RA. Wood, The natural history of IgE-mediated cow's milk allergy., in J Allergy Clin Immunol, vol. 120, n. 5, novembre 2007, pp. 1172-7, DOI:10.1016/j.jaci.2007.08.023, PMID 17935766.
- ^ JH. Savage, EC. Matsui; JM. Skripak; RA. Wood, The natural history of egg allergy., in J Allergy Clin Immunol, vol. 120, n. 6, dicembre 2007, pp. 1413-7, DOI:10.1016/j.jaci.2007.09.040, PMID 18073126.
- ^ a b DM. Fleischer, MK. Conover-Walker; L. Christie; AW. Burks; RA. Wood, The natural progression of peanut allergy: Resolution and the possibility of recurrence., in J Allergy Clin Immunol, vol. 112, n. 1, luglio 2003, pp. 183-9, PMID 12847497.
- ^ S. Mehr, A. Kakakios; K. Frith; AS. Kemp, Food protein-induced enterocolitis syndrome: 16-year experience., in Pediatrics, vol. 123, n. 3, marzo 2009, pp. e459-64, DOI:10.1542/peds.2008-2029, PMID 19188266.
- ^ AH. Assa'ad, PE. Putnam; MH. Collins; RM. Akers; SC. Jameson; CL. Kirby; BK. Buckmeier; JZ. Bullock; AR. Collier; MR. Konikoff; RJ. Noel, Pediatric patients with eosinophilic esophagitis: an 8-year follow-up., in J Allergy Clin Immunol, vol. 119, n. 3, marzo 2007, pp. 731-8, DOI:10.1016/j.jaci.2006.10.044, PMID 17258309.
- ^ EA. Pastorello, L. Stocchi; V. Pravettoni; A. Bigi; ML. Schilke; C. Incorvaia; C. Zanussi, Role of the elimination diet in adults with food allergy., in J Allergy Clin Immunol, vol. 84, 4 Pt 1, ottobre 1989, pp. 475-83, PMID 2794292.
- ^ a b H. Lemon-Mulé, HA. Sampson; SH. Sicherer; WG. Shreffler; S. Noone; A. Nowak-Wegrzyn, Immunologic changes in children with egg allergy ingesting extensively heated egg., in J Allergy Clin Immunol, vol. 122, n. 5, novembre 2008, pp. 977-983.e1, DOI:10.1016/j.jaci.2008.09.007, PMID 18851876.
- ^ (FR) Stratégie mondiale pour l’alimentation du nourrisson et du jeune enfant (PDF), su who.int, Organizzazione mondiale della sanità, 2003. URL consultato il 24 febbraio 2022 (archiviato dall'url originale il 19 gennaio 2022).
- ^ RS. Zeiger, S. Heller, The development and prediction of atopy in high-risk children: follow-up at age seven years in a prospective randomized study of combined maternal and infant food allergen avoidance., in J Allergy Clin Immunol, vol. 95, n. 6, giugno 1995, pp. 1179-90, PMID 7797786.
- ^ Ngan J, Kind LS,, Suppressor T cells for IgE and IgG in Peyer's patches of mice made tolerant by the oral administration of ovalbumin, in J Immunol, vol. 120, 1978, pp. 861-865, PMID 305448.
- ^ JA. Poole, K. Barriga; DY. Leung; M. Hoffman; GS. Eisenbarth; M. Rewers; JM. Norris, Timing of initial exposure to cereal grains and the risk of wheat allergy., in Pediatrics, vol. 117, n. 6, giugno 2006, pp. 2175-82, DOI:10.1542/peds.2005-1803, PMID 16740862.
- ^ a b JM. James, RS. Zeiger; MR. Lester; MB. Fasano; JE. Gern; LE. Mansfield; HJ. Schwartz; HA. Sampson; HH. Windom; SB. Machtinger; S. Lensing, Safe administration of influenza vaccine to patients with egg allergy., in J Pediatr, vol. 133, n. 5, novembre 1998, pp. 624-8, PMID 9821418.
- ^ Food allergy: a practice parameter. (PDF), in Ann Allergy Asthma Immunol, vol. 96, 3 Suppl 2, marzo 2006, pp. S1-68, PMID 16597066.
- ^ A. Nowak-Wegrzyn, AH. Assa'ad; SL. Bahna; SA. Bock; SH. Sicherer; SS. Teuber, Work Group report: oral food challenge testing., in J Allergy Clin Immunol, vol. 123, 6 Suppl, giugno 2009, pp. S365-83, DOI:10.1016/j.jaci.2009.03.042, PMID 19500710.
- ^ F. Rancé, A. Deschildre; F. Villard-Truc; SA. Gomez; E. Paty; C. Santos; L. Couderc; JL. Fauquert; J. De Blic; E. Bidat; C. Dupont, Oral food challenge in children: an expert review., in Eur Ann Allergy Clin Immunol, vol. 41, n. 2, aprile 2009, pp. 35-49, PMID 19585859.
- ^ M. Henzgen, BK. Ballmer-Weber; S. Erdmann; T. Fuchs; J. Kleine-Tebbe; U. Lepp; B. Niggemann; M. Raithel; I. Reese; J. Saloga; S. Vieths, Skin testing with food allergens. Guideline of the German Society of Allergology and Clinical Immunology (DGAKI), the Physicians' Association of German Allergologists (ADA) and the Society of Pediatric Allergology (GPA) together with the Swiss Society of Allergology., in J Dtsch Dermatol Ges, vol. 6, n. 11, novembre 2008, pp. 983-8, DOI:10.1111/j.1610-0387.2008.06889.x, PMID 18992038.
- ^ GT Furuta, Forbes D, Boey C, Dupont C, Putnam P, Roy S, Sabrá A, SalvatierraA, Yamashiro Y, Husby S;, Eosinophilic Gastrointestinal Diseases Working Group.Eosinophilic gastrointestinal diseases (EGIDs), in J Pediatr Gastroenterol Nutr., vol. 47, n. 2, agosto 2008, pp. 234-8, PMID 18664881, ..
- ^ FR. Greer, SH. Sicherer; AW. Burks, Effects of early nutritional interventions on the development of atopic disease in infants and children: the role of maternal dietary restriction, breastfeeding, timing of introduction of complementary foods, and hydrolyzed formulas., in Pediatrics, vol. 121, n. 1, gennaio 2008, pp. 183-91, DOI:10.1542/peds.2007-3022, PMID 18166574.
- ^ Contact dermatitis: a practice parameter., in Ann Allergy Asthma Immunol, vol. 97, 3 Suppl 2, settembre 2006, pp. S1-38, PMID 17039663.
- ^ M. Piquer-Gibert, Plaza-Martín A, Martorell-Aragonés A, Ferré-Ybarz L,Echeverría-Zudaire L, Boné-Calvo J, Nevot-Falcó S;, Food Allergy Committee of the Sociedad Española de Inmunología Clínica y Alergología Pediátrica.Recommendations for administering the triple viral vaccine and antiinfluenzavaccine in patients with egg allergy., in Allergol Immunopathol (Madr), vol. 35, n. 2, Sep-Oct 2007, pp. 209-12, PMID 17923075.
- ^ A. Fiocchi, Assa'ad A, Bahna S; Adverse Reactions to Foods Committee; American College of Allergy, Asthma and Immunology., Food allergy and the introduction of solid foods to infants: a consensus document. Adverse Reactions to FoodsCommittee, American College of Allergy, Asthma and Immunology, in Ann Allergy Asthma Immunol., vol. 97, n. 1, luglio 2006, pp. 10-20, PMID 16892776.
- ^ School guidelines for managing students with food allergies., in School Nurse News, vol. 23, n. 3, maggio 2006, pp. 13-4, PMID 16736988.
Bibliografia
[modifica | modifica wikitesto]- Antonella Muraro, Graham Roberts e al., Food Allergy and Anaphylaxis Guidelines (PDF), European Academy of Allergy and Clinical Immunology, 2014. URL consultato il 28 febbraio 2017 (archiviato dall'url originale il 21 settembre 2015).
- EFSA - Panel on Dietetic Products, Nutrition and Allergies, Scientific Opinion on the evaluation of allergenic foods and food ingredients for labelling purposes, in EFSA Journal, 2014, pp. 3894-3180.
Voci correlate
[modifica | modifica wikitesto]- Additivi alimentari
- Allergia
- Angioedema
- Antistaminico
- Asma
- Cromone
- Dermatite atopica
- Disturbi dell'alimentazione
- Eczema
- Immunologia
- Intolleranza (medicina)
- Intolleranza al lattosio
- Mastociti
- Mastocitosi
- Mastocitosi sistemica
- Mastocitosi cutanea
- Orticaria
- Orticaria colinergica
- Orticaria solare
- Orticaria cronica
- Pronto soccorso
- Reazioni di ipersensibilità
- Shock anafilattico
- Sindrome alfa-gal
- Steroide
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «allergia alimentare»
Wikizionario contiene il lemma di dizionario «allergia alimentare» Wikimedia Commons contiene immagini o altri file su allergia alimentare
Wikimedia Commons contiene immagini o altri file su allergia alimentare
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Erin Fitch, food allergy, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Associazione Italiana Allergie Alimentari, su foodallergyitalia.org.
- (EN) Sito con un completo data base allergologico per alimenti, su foodallergens.ifr.ac.uk. URL consultato il 15 aprile 2010 (archiviato dall'url originale il 30 novembre 2009).
- (EN) European Academy of Allergy and clinical Immunology, su eaaci.org. URL consultato il 28 febbraio 2017 (archiviato dall'url originale il 19 gennaio 2017).
- (EN) CDC.gov - p. Allergie alimentari, su cdc.gov.
- (EN) American Academy of Allergy Asthma & Immunology - p. Allergie alimentari, su aaaai.org.
- (EN) Asthma and Allergy Foundation of America, su aafa.org.
- (DE) Banca dati su oltre 4000 allergeni, su alles-zur-allergologie.de.
- Informall, su research.bmh.manchester.ac.uk.
- Structural Database of Allergenic Proteins - Database delle proteine allergeniche, su fermi.utmb.edu.
Riviste scientifiche
[modifica | modifica wikitesto]- The Journal of Immunology, su jimmunol.org.
- Journal of Autoimmune Diseases, su jautoimdis.com.
- The Journal of allergy and clinical immunology [collegamento interrotto], su jacionline.org.
- Clinical Reviews in Allergy and Immunology [collegamento interrotto], su springerlink.com.
- Pediatric Allergy and Immunology, su wiley.com.
- Clinical Reviews in Allergy [collegamento interrotto], su www3.interscience.wiley.com.
- Nutrition Bulletin [collegamento interrotto], su www3.interscience.wiley.com.
- Food and nutrition bulletin, su foodandnutritionbulletin.org. URL consultato il 7 aprile 2010 (archiviato dall'url originale il 23 agosto 2009).
| Controllo di autorità | Thesaurus BNCF 22262 · LCCN (EN) sh85050258 · GND (DE) 4034871-4 · BNE (ES) XX528529 (data) · BNF (FR) cb11964750j (data) · J9U (EN, HE) 987007543193905171 · NDL (EN, JA) 01052131 |
|---|