Կատալիզ
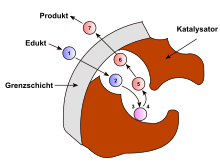
Կատալիզ (հունարեն՝ χατάλνσιξ - տրոհում), քիմիական ռեակցիայի արագության փոփոխություն կատալիզատորների ազդեցությամբ, որոնք ռեակցիայի ընթացքում քանակապես անփոփոխ են մնում։
Քիմիական ռեակցիայի արագության մեծացման դեպքում կատալիզ կոչվում է դրական, փոքրացման դեպքում՝ բացասական։ Կատալիզատորների մասնակցությամբ ընթացող ռեակցիաները կոչվում են կատալիտիկ։ Եթե կատալիզատորը գոյանում է ռեակցիայի ընթացքում, ապա ռեակցիան կոչվում է ինքնակատալիզված, իսկ երևույթը՝ ինքնակատալիզ։
Ռեակցիաների բացարձակ արագությունների տեսության համաձայն ցանկացած տարրական ռեակցիա ընթանում է ռեագենտների փոխազդեցության հետևանքով միջանկյալ շատ ռեակցունակ գոյացության՝ ակտիվ կոմպլեքսի առաջացման վրայով՝
- ելանյութեր ակտիվ կոմպլեքս վերջնանյութեր։
Ըստ այս մոդելի, ռեակցիայի արագությունը համեմատական է ակտիվացման պրոցեսի ստանդարտ ազատ էներգիայի () փոփոխությանը։ Եթե կատալիզատորի բացա��այությամբ ստանդարտ ազատ էներգիան (չկ) է և կատալիզատորի ներկայությամբ՝ (կ), ապա (կ) < (չկ)։ -նրի տարբերությունը հետևանք է այն բանի, որ չկատալիզված և կատալիզված ռեակցիաներն ընթանում են տարբեր մեխանիզմներով։
Հիմնական սկզբունքներ
[խմբագրել | խմբագրել կոդը]
A-ելային վիճակ, B-միջանկյալ միացություն, C-վերջնանյութերի, X1, X2’, X2’’ - ակտիվացված կոմպլեքսների համապատասխան վիճակներ
Կատալիզատորի ներկայությամբ ռեակցիան ընթանում է նոր, ավելի հարմար ուղիով։ Ռեակցիայի նոր ճանապարհն ավելի ձեռնտու է, որովհետև նրա իրականացման համար պահանջվում է ավելի փոքր ակտիվացման էներգիա։ Ըստ գծագրի, չկատալիզված և կատալիզված ռեակցիաների ակտիվացման էներգիաների տարբերությունը հավասար է
կամ
Եթե ելանյութի և կատալիզի փոխազդեցության հետևանքով չի առաջանում միջանկյալ կայուն միացություն, ապա կատալիզված ռեակցիայի ընթացքը կպատկերվի (3) կորով։
Կատալիզատորի ազդեցության վերաբերյալ բերված պատկերումից հետևում է՝
- կատալիզատորը փոխում է ռեակցիայի մեխանիզմը՝ մասնակցելով ռեակցիայի միջանկյալ փուլերին.
- ռեակցիայի վերջում այն քանակապես վերականգնվում է.
- կատալիզատորի ներկայությամբ փոխվում է ակտիվ կոմպլեքսի բաղադրությունը (X1-ի փոխարեն ստացվում է X2)։
Ուրեմն, կատալիզը երևույթ է, երբ ակտիվ կոմպլեքսի բաղադրության մեջ մտնում է մի նյութ, որը, ռեակցիայի ընթացքում քանակապես անփոփոխ մնալով, փոխում է ռեակցիայի մեխանիզմը։ Որոշ դեպքերում կատալիզատորների առկայությամբ ռեակցիայի ընթացքում ծնունդ են առնում էներգիայով հարուստ միջանկյալ մասնիկներ, որոնք արագացնում են ռեակցիան (ճյուղավորված շղթայական ռեակցիաներ), օրինակ,
- ռեակցիան կատալիզվում է ջրով, որի առկայությամբ ծնունդ են առնում H և OH- ռեակցունակ միջանկյալ մասնիկները։
Տեսակներ
[խմբագրել | խմբագրել կոդը]Գոյություն ունեն համասեռ (հոմոգեն) և տարասեռ (հետերոգեն) կատալիզներ։
Հոմոգեն
[խմբագրել | խմբագրել կոդը]Համասեռի դեպքում ռեագենտները և կատալիզատորը գտնվում են միևնույն ֆազում։ Ռեագենտները և կատալիզատորը, օրինակ, գազեր են
հեղուկներ
պինդ նյութեր
Հետերոգեն
[խմբագրել | խմբագրել կոդը]Տարասեռի դեպքում ռեագենտները և կատալիզատորը գտնվում են տարբեր ֆազերում, օրինակ,
Միջանկյալ միկրոտարասեռ կատալիզը, երբ կատալիզատորը գտնվում է կոլոիդային վիճակում կամ բարձրմոլեկուլային նյութ է, օրինակ, միցելները, ֆերմենտները։
Կատալիզված ռեակցիաներ
[խմբագրել | խմբագրել կոդը]Ըստ ռեագենտի և կատալիզատորի փոխազդեցության բնույթի, կատալիզված ռեակցիաները լինում են թթվահիմնային և օքսիդավերականգնման։
Թթվահիմնային կատալիզ
[խմբագրել | խմբագրել կոդը]Թթվայինի դեպքում H+ է անցնում կատալիզատորից (HA) ռեագենտին (C)՝
հիմնայինի դեպքում՝ OH կամ H+ հակառակ ուղղությամբ։ Ապրոտոնային թթուների (Լյուիսի թթուների) առկայությամբ ռեագենտ-կատալիզատոր փոխազդեցությունը իրականանում է էլեկտրոնների զույգի մասնակցությամբ։ Թթվահիմնային կատալիզ կարող է տեղի ունենալ իոնափոխանակային խեժերի առկայությամբ։
Օքսիդավերականգնման կատալիզ
[խմբագրել | խմբագրել կոդը]Օքսիդավերականգնման կատալիզի դեպքում ռեագենտ-կատալիզաաոր փոխազդեցությունը տեղի է ունենում էլեկտրոնների անցումով։ Կիսահաղորդչային կատալիզատորը պատկանում է այդ դասին։ Օքսիդավերականգնման ռեակցիաներում կատալիզելու ակտիվություն ունեն հատկապես d-տարրերը։
Առանձնահատկություններ
[խմբագրել | խմբագրել կոդը]Կատալիզին հատուկ են մի շարք առանձնահատկություններ՝ ազդեցության յուրահատկություն (յուրաքանչյուր քիմիական ռեակցիակամ նմանատիպ ռեակցիաների դաս կարող է կատալիզվել միայն որոշակի նյութերով)։ Այս հատկությունը առավել ցայտուն է ֆերմենտների մոտ։ Կատալիզատորի այս հատկության չափանիշը կատալիզատորի ընտրողականությունն է։ Սա արագությունների հարաբերություն է՝ հայտարարը ելանյութի սպառման արագությունն է, համարիչը՝ հետաքրքրության առարկա հանդիսացող նյութի կուտակման արագությունը։
Կատալիտիկ ակտիվությունը որոշվում է կատալիզատորի միավոր զանգվածին, կոնցենտրացիային կամ մակերեսին ընկնող ռեակցիայի արագությամբ։ Պրոմոտորների ներկայությամբ կատալիզատորի ակտիվությունը մեծանում է, թույների (ինհիբիտորների) ներկայությամբ՝ նվազում։ Կատալիզատորի բաղադրության ընտրությունը բարդ խնդիր է, կատարվում է փորձարարական ճանապարհով։
Տես նաև
[խմբագրել | խմբագրել կոդը]Գրականություն
[խմբագրել | խմբագրել կոդը]- Боресков Г. К. Катализ. Вопросы теории и практики. — Новосибирск, 1987.
- Гейтс Б. Химия каталитических процессов / Б. Гейтс, Дж. Кетцир, Г. Шуйт. — М.: Мир, 1981. — 551 с.
- Журнал «Кинетика и катализ Արխիվացված 2004-10-13 Wayback Machine».
- Колесников И. М. Катализ и производство катализаторов. — М.: Техника, 2004. — 399 с.
- Яблонский Г. С., Быков В. И., Горбань А. Н. Кинетические модели каталитических реакций. — Новосибирск: Наука (Сиб. отделение), 1983. — 255 c.
Արտաքին հղումներ
[խմբագրել | խմբագրել կոդը]- Science Aid: Catalysts Արխիվացված 2008-05-30 Wayback Machine Page for high school level science
- W.A. Herrmann Technische Universität presentation Արխիվացված 2005-10-28 Wayback Machine
- Alumite Catalyst, Kameyama-Sakurai Laboratory, Japan
- Inorganic Chemistry and Catalysis Group, Utrecht University, The Netherlands
- Centre for Surface Chemistry and Catalysis Արխիվացված 2008-10-05 Wayback Machine
| Այս հոդվածի կամ նրա բաժնի որոշակի հատվածի սկզբնական կամ ներկայիս տարբերակը վերցված է Քրիեյթիվ Քոմմոնս Նշում–Համանման տարածում 3.0 (Creative Commons BY-SA 3.0) ազատ թույլատրագրով թողարկված Հայկական սովետական հանրագիտարանից (հ․ 5, էջ 282)։ |












