Ացետալդեհիդ
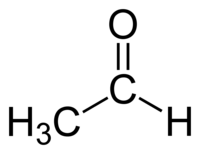
Ացետալդեհիդ (քացախալդեհիդ, էթանալ)՝ ալդեհիդների դասին պատկանող օրգանական միացություն է։ Քիմիական բանաձևը՝ СH3СHO, մոլեկուլը պարունակում է կարբոնիլային (կամ օքսո-) խումբ։ Ացետալդեհիդը մեծ քանակությամբ հանդիպում է բնության մեջ, մեծ քանակներով ստանում են արդյունաբերական եղանակով։ Ացետալդեհիդը հանդիպում է սուրճի, հասած մրգերի, հացի մեջ, սինթեզվում է բույսերի կողմից։ Ստանում են նաև էթանոլի օքսիդացումով։ Ացետալդեհիդով թունավորմամբ է պայմանավորվում նաև ալկոհոլի չարաշահումից հետո առաջացող գլխացավը և մյուս համախտանիշները։
| Ացետալդեհիդ | |
|---|---|
 | |
 | |
| Ընդհանուր տեղեկություններ | |
| Դասական անվանակարգում | էթանալ |
| Ավանդական անվանում | ացետալդեհիդ, քացախալդեհիդ, մեթիլֆորմալդեհիդ |
| Քիմիական բանաձև | C₂H₄O |
| Ռացիոնալ բանաձև | С2H4O C 54,53 %, H 9,15 %, O 36,32 % |
| Ֆիզիկական հատկություններ | |
| Ագրեգատային վիճակ | անգույն հեղուկ է եթերային բույրով |
| Մոլային զանգված | 7,3E−26 կիլոգրամ[1] գ/մոլ |
| Խտություն | 0,79 ± 0,01 գ/սմ³[2] գ/սմ³ |
| Դինամիկ մածուցիկություն | ~0,215 20 °C-ում Պա/վ |
| Իոնիզացման էներգիա | 10,22 ± 0,01 Էլեկտրոն-վոլտ[2] և 1,6E−18 ջոուլ[3] կՋ/մոլ |
| Ջերմային հատկություններ | |
| Հալման ջերմաստիճան | −190 ± 1 ℉[2], −123 °C[4][3] և −128 °C[5] °C |
| Եռման ջերմաստիճան | 69 ± 0 ℉[2], 20,2 °C[4] և 20,1 °C[3] °C |
| Այրման ջերմաստիճան | −36 ± 1 ℉[2] |
| Բռնկման ջերմաստիճան | 234,15 K (−39 °C) °C |
| Ինքնաբռնկման ջերմաստիճան | 185 ± 1 °C[6] |
| Եռյակ կետ | -114,3 °C |
| Կրիտիկական ճնշում | 192,85 մթն. |
| Մոլյար ջերմատարողություն | 1,197 Ջ/(մոլ•Կ) |
| Գոյացան էնթալպիա | -166 կՋ/մոլ |
| Գոլորշու ճնշում | 740 ± 1 mm Hg[2] |
| Քիմիական հատկություններ | |
| Լուծելիությունը ջուր-ում | Ցանկացած հարաբերությամբ լուծվում է ջրում և էթանոլում գ/100 մլ |
| pKa | 13,57 (25 °C) |
| Օպտիկական հատկություններ | |
| Բեկման ցուցիչ | 1,3316 |
| Կառուցվածք | |
| Դիպոլ մոմենտ | 2,750 ± 0,006 |
| Դասակարգում | |
| CAS համար | 75-07-0 |
| PubChem | 177 |
| EINECS համար | 200-836-8 |
| SMILES | CC=O |
| ЕС | 200-836-8 |
| RTECS | AB1925000 |
| ChEBI | 172 |
| Թունավորություն | |
| ՍԹԿ | 5 մգ/մ3 |
| ՄԲ50 | 1232 մգ/կգ, 900 մգ/կգ (մկներ), 661 մգ/կգ (առնետներ) |
| Թունավորություն | թունավոր է, քաղցկեղածին   |
| IDLH | 2000 ± 1 parts per million[2] և 3600 ± 100 mg/m³[2] |
| Եթե հատուկ նշված չէ, ապա բոլոր արժեքները բերված են ստանդարտ պայմանների համար (25 °C, 100 կՊա) | |
Ֆիզիկական հատկություններ
խմբագրելԱցետալդեհիդը եթերային ուժեղ հոտով, անգույն հեղուկ է, հեշտությամբ լուծվում է ջրում, սպիրտներում, եթերներում։ Շատ ցածր եռման ջերմաստիճանի (20,2 °C) պատճառով պահում և տեղափոխում են տրիմերների ձևով, որոնցից այն կարող են հետ ստանալ հանքային թթուների հետ տաքացնելով (հիմնականում ծծմբական թթվի)։
Ստացում
խմբագրել2003 թվականին համաշխարհային արտադրությունը 1 տարում կազմել է մոտ 1 միլիոն տոննա։ Ստացման հիմնական եղանակը էթիլենի օքսիդացումն է (Վագների եղանակ[7])։
Այն ստանում են նաև Կուչերովի ռեակցիայով.
Ացետիլենի հիդրատացումով ստանում են նաև քացախաթթու, ռութենիումի աղերի առկայությամբ (Կուչերովի ռեակցիա).
Ստանում են նաև էթիլ սպիրտի դեհիդրումից կամ օքսիդացումից, պղնձի կամ արծաթի կատալիզատորների առկայությամբ.
Հատկություններ
խմբագրելԿատալիզատորների, օրինակ մանգանի աղերի ներկայությամբ, ացետիլենը հեշտությամբ օքսիդանում է օդի թթվածնով և վերածվում քացախաթթվի՝
Քացախադեհիդի վրա մի քանի կաթիլ խիտ ծծմբական թթվով ազդելիս նա փոխարկվում է մի նյութի, որը եռում է 124 °C-ում, այսինքն՝ ավելի բարձր ջերմաստիճանում, քան քացախալդեհիդի եռման աստիճանն է։ Այդ նյութը կոչվում է պարալդեհիդ։
Պարալդեհիդ
խմբագրելՊարալդեհիդի գոլորշիների խտությունը ըստ ջրածնի հավասար է 66-ի. հետևաբար, նրա մոլեկուլային կշիռը հավասար է 132-ի։ Քացախալդեհիդի երեք մոլեկուլները միանալով առաջացնում են մեկ մոլեկուլ պարալդեհիդ։
Պարալդեհիդը չի ցուցաբերում ալդեհիդներին բնորոշ ռեակցիաներ, չի վերականգնում արծաթի օքսիդի մոնիակային լուծույթը, ֆուքսինծծմբային թթվի հետ գունավորում չի առաջացնում։ Թույլ ծծմբական թթվի հետ տաքացնելիս պարալդեհիդը նորից վերածվում է հեշտ ցնդելի քացախալդեհիդ։ Քացախալդեհիդի մոլեկուլների միջև եղած կապը չունի առանձնահատուկ ամրություն։ Քանի որ ածխածնի ատոմների միջև եղած կապը բավական ամուր է և չի քայքայվում նյութը թույլ ծծմբական թթվի հետ տաքացնելիս։ Պարալդեհիդի առաջացման ժամանակ ճեղքվում է քացախալդեհիդի մոլեկուլում ածխածնի և թթվածնի ատոմների միջև եղած կրկնակի կապը և թթվածնի ու ածխածնի ատոմների մոտ ազատվում են վալենտականության մեկական միավորներ, որոնք փոխադարձ կերպով հագենում են քացախալդեհիդի երեք մոլեկուլներով։
Ցածր ջերմաստիճանում քացախալդեհիդի վրա ազդելով ծծմբական թթվով առաջանում է մի ուրիշ պոլիմեր՝ բյուրեղային մեթալդեհիդ (C2H4O)4։ Մեթիլալդեհիդը, պալալդեհիդի նման, նորից կարող է վերածվել քացախալդեհիդի։
Կոնդենսման ռեակցիաներ
խմբագրելԿարբոնիլի նկատմամբ α-տեղում շարժուն ջրածնի ատոմ ունեցող ալդեհիդներն ու կետոնները հիմնային միջավայրում հակում ունեն մտնելու կոնդենս��ան ռեակցիաների մեջ, որի արդյունքում երկարում է ածխաջրածնային շղթան։ Այդ ռեակցիաներից են ալդոլ- և կետոլկոնդենսումները, որոնց ժամանակ առաջանում են ալդոլ և կետոլ։ Ալդեհիդային և հիդրօքսիլային ֆունկցիոնալ խումբ պարունակող միացությունները կոչվում են ալդոլ, իսկ կետոնային և հիդրօքսիլային խմբեր պարունակողները՝ կետոլ։
Ծանոթագրություններ
խմբագրել- ↑ 1,0 1,1 acetaldehyde
- ↑ 2,00 2,01 2,02 2,03 2,04 2,05 2,06 2,07 2,08 2,09 2,10 2,11 http://www.cdc.gov/niosh/npg/npgd0001.html
- ↑ 3,0 3,1 3,2 3,3 3,4 3,5 David R. Lide, Jr. Basic laboratory and industrial chemicals: A CRC quick reference handbook — CRC Press, 1993. — ISBN 978-0-8493-4498-5
- ↑ 4,0 4,1 4,2 4,3 ACETALDEHYDE
- ↑ 5,0 5,1 Bradley J., Williams A. J., Andrew S.I.D. Lang Jean-Claude Bradley Open Melting Point Dataset // Figshare — 2014. — doi:10.6084/M9.FIGSHARE.1031637.V2
- ↑ http://www.cdc.gov/niosh/ipcsneng/neng0009.html
- ↑ en:Wacker process
Արտաքին հղումներ
խմբագրել- SEKAB, a producer of green Acetaldehyde [1]
- International Chemical Safety Card 0009
- National Pollutant Inventory – Acetaldehde Արխիվացված 2009-07-10 Wayback Machine
- NIOSH Pocket Guide to Chemical Hazards
- Methods for sampling and analysis
- IARC Monograph: "Acetaldehyde" Արխիվացված 2018-06-22 Wayback Machine
- Hal Kibbey, Genetic Influences on Alcohol Drinking and Alcoholism, Indiana University Research and Creative Activity, Vol. 17 no. 3.
- United States Food and Drug Administration (FDA) information for acetaldehyde Արխիվացված 2004-10-09 Wayback Machine
- Acetaldehyde production process flow sheet by ethylene oxidation method
Գրականություն
խմբագրել- Բ. Ա. Պավլով, Ա. Պ. Տերենտև /Օրգանական քիմիայի դասընթաց/
| Վիքիպահեստն ունի նյութեր, որոնք վերաբերում են «Ացետալդեհիդ» հոդվածին։ |