Αλδολική συμπύκνωση
Αλδολική συμπύκνωση (Aldol condensation) είναι μια αντίδραση συμπύκνωσης στην οργανική χημεία στην οποία δύο τμήματα καρβονυλομάδων (από αλδεΰδες ή κετόνες) αντιδρούν για να σχηματίσουν μια β-υδροξυαλδεΰδη ή β-υδροξυκετόνη (μια αντίδραση αλδόλης), και στη συνέχεια ακολουθείται με αφυδάτωση για να δώσει μια συζευγμένη ενόνη. Η συνολική εξίσωση της αντίδρασης είναι η εξής (όπου το Rs μπορεί να είναι H)
| Αλδολική συμπύκνωση | |
|---|---|
| Τύπος αντίδρασης | Αντίδραση συμπύκνωσης |
| Αναγνωριστικά | |
| Όνομα Οργανικής Χημείας | Αλδολική συμπύκνωση |
| ID οντολογίας RSC | RXNO:0000017 |
Οι συμπυκνώσεις αλδόλης είναι σημαντικές στην οργανική σύνθεση και στη βιοχημεία ως τρόποι σχηματισμού δεσμών άνθρακα-άνθρακα.[1][2][3][4] Στη συνηθισμένη μορφή τους, περιλαμβάνει την πυρηνόφιλη προσθήκη μιας ενολικής κετόνης σε μια αλδεΰδη για να σχηματιστεί μια β-υδροξυ κετόνη, ή αλδόλη ( αλδεΰδη + αλκοόλη), μια δομική μονάδα που βρίσκεται σε πολλά μόρια και φάρμακα.[5][6][7]
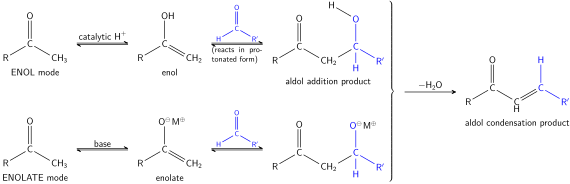
Ο όρος αλδολική συμπύκνωση χρησιμοποιείται επίσης συνήθως, ειδικά στη βιοχημεία, για να αναφέρεται μόνο στο πρώτο στάδιο (προσθήκης) της διαδικασίας—την ίδια την αλδολική αντίδραση—όπως καταλύεται από αλδολάσες . Ωστόσο, το πρώτο βήμα είναι τυπικά μια αντίδραση προσθήκης και όχι μια αντίδραση συμπύκνωσης επειδή δεν περιλαμβάνει την απώλεια ενός μικρού μορίου.
Μηχανισμός
ΕπεξεργασίαΤο πρώτο μέρος αυτής της αντίδρασης είναι μια αλδολική αντίδραση, το δεύτερο μέρος μια αφυδάτωση—μια αντίδραση απόσπασης (Περιλαμβάνει την αφαίρεση ενός μορίου νερού ή ενός μορίου αλκοόλης). Η αφυδάτωση μπορεί να συνοδεύεται από αποκαρβοξυλίωση όταν υπάρχει ενεργοποιημένη καρβοξυλική ομάδα. Το προϊόν προσθήκης αλδόλης μπορεί να αφυδατωθεί μέσω δύο μηχανισμών. Μια ισχυρή βάση όπως t-βουτοξείδιο του καλίου, υδροξείδιο του καλίου ή υδρίδιο του νατρίου αποπρωτονιώνει το προϊόν σε ενολικό, το οποίο αποβάλλεται μέσω του μηχανισμού E1cB,[8][9] ενώ η αφυδάτωση σε οξύ προχωρά μέσω ενός μηχανισμού αντίδρασης Ε1. Ανάλογα με τη φύση του επιθυμητού προϊόντος, η συμπύκνωση αλδόλης μπορεί να πραγματοποιηθεί υπό δύο γενικούς τύπους συνθηκών: κινητικό έλεγχο ή θερμοδυναμικό έλεγχο.[10] Τόσο οι κετόνες όσο και οι αλδεΰδες είναι κατάλληλες για αντιδράσεις συμπύκνωσης αλδόλης. Στα παρακάτω παραδείγματα, χρησιμοποιούνται αλδεΰδες.
Συμπύκνωση αλδόλης που καταλύεται με βάση
Επεξεργασία- Ο μηχανισμός για την καταλυόμενη από βάση συμπύκνωση αλδόλης φαίνεται στην παρακάτω εικόνα.
Η διαδικασία ξεκινά όταν ένα ελεύθερο υδροξείδιο (ισχυρή βάση) απογυμνώνει το εξαιρετικά όξινο πρωτόνιο στον άλφα άνθρακα της αλδεΰδης. Αυτή η αποπρωτονίωση αναγκάζει τα ηλεκτρόνια από τον δεσμό C-H να μετατοπιστούν και να δημιουργήσουν έναν νέο δεσμό π C-C. Ο νέος δεσμός π δρα στη συνέχεια ως πυρηνόφιλος και προσβάλλει την υπόλοιπη αλδεΰδη στο διάλυμα, με αποτέλεσμα το σχηματισμό ενός νέου δεσμού C-C και την αναγέννηση του βασικού καταλύτη.
- Στο δεύτερο μέρος της αντίδρασης, η παρουσία βάσης οδηγεί σε αποβολή νερού και σχηματισμό νέου δεσμού π C-C. Το προϊόν αναφέρεται ως προϊόν αλδολικής συμπύκνωσης.
Συμπύκνωση αλδόλης που καταλύεται από οξύ
Επεξεργασία- Ο μηχανισμός για την καταλυόμενη από οξύ συμπύκνωση αλδόλης φαίνεται στην παρακάτω εικόνα.
Ένας μηχανισμός για τη συμπύκνωση αλδόλης σε όξινες συνθήκες, που λαμβάνει χώρα μέσω των ενδιάμεσων ενολών και μιας αντίδρασης απόσπασης.
| Αναπαράσταση, με καταλύτη βάση | Αναπαράσταση, με καταλύτη οξύ |
Διασταυρούμενη αλδολική συμπύκνωση
ΕπεξεργασίαΜια διασταυρούμενη αλδολική συμπύκνωση είναι αποτέλεσμα δύο ανόμοιων καρβονυλικών ενώσεων που περιέχουν α-υδρογόνο που υφίστανται αλδολική συμπύκνωση. Συνήθως, αυτό οδηγεί σε τέσσερα πιθανά προϊόντα, καθώς η καρβονυλική ένωση μπορεί να δράσει ως πυρηνόφιλη και η αυτοσυμπύκνωση είναι δυνατή, γεγονός που καθιστά ένα συνθετικά μείγμα άχρηστο. Ωστόσο, αυτό το πρόβλημα μπορεί να αποφευχθεί εάν μία από τις ενώσεις δεν περιέχει α-υδρογόνο, καθιστώντας τες μη ενολοποιήσιμες. Σε μια αλδολική συμπύκνωση μεταξύ μιας αλδεΰδης και μιας κετόνης, η κετόνη δρα ως πυρηνόφιλο, καθώς ο καρβονυλικός άνθρακας της δεν έχει υψηλό ηλεκτρονιοφιλικό χαρακτήρα λόγω του επαγωγικής επίδρασης και της στερεοχημικής παρεμπόδισης. Συνήθως, το διασταυρωμένο προϊόν είναι το κύριο. Οποιαδήποτε ίχνη του προϊόντος αυτο-αλδόλης από την αλδεΰδη μπορούν να απορριφθούν παρασκευάζοντας πρώτα ένα μείγμα κατάλληλης βάσης και της κετόνης και στη συνέχεια προσθέτοντας αργά την αλδεΰδη στο εν λόγω μίγμα αντίδρασης. Η χρήση πολύ συμπυκνωμένης βάσης θα μπορούσε να οδηγήσει σε μια ανταγωνιστική αντίδραση Cannizzaro.[11]
Παραδείγματα
ΕπεξεργασίαΗ διεργασία Aldox, που αναπτύχθηκε από τις Shell plc και Exxon, μετατρέπει το προπένιο και το αέριο σύνθεσης σε 2-αιθυλεξανόλη μέσω υδροφορμυλίωσης σε βουτανάλη, συμπύκνωση αλδόλης σε 2-αιθυλεξανάλη και τέλος υδρογόνωση.[12]
H πενταερυθριτόλη παράγεται σε μεγάλη κλίμακα ξεκινώντας με διασταυρούμενη αλδολική συμπύκνωση της ακεταλδεΰδης και τριών ισοδυνάμων της φορμαλδεΰδης για να δώσει πενταερυθρόζη, η οποία ανάγεται περαιτέρω σε αντίδραση Cannizzaro.[13]
Εύρος
ΕπεξεργασίαΟ 2-μεθυλακετοξικός αιθυλεστέρας και η καμφολενική αλδεΰδη αντιδρούν σε αλδολική συμπύκνωση.[14] Η συνθετική διαδικασία [15] είναι τυπική για αυτόν τον τύπο αντίδρασης. Κατά τη διαδικασία, εκτός από το νερό, ένα ισοδύναμο αιθανόλης και διοξειδίου του άνθρακα χάνονται σε αποκαρβοξυλίωση.
Περιστασιακά, μια αλδολική συμπύκνωση θάβεται σε μια αντίδραση πολλαπλών σταδίων ή σε καταλυτικό κύκλο. [16]
Άλλες αντιδράσεις συμπύκνωσης
ΕπεξεργασίαΥπάρχουν και άλλες αντιδράσεις καρβονυλικών ενώσεων παρόμοιες με την αλδολική συμπύκνωση:
- Όταν η βάση είναι μια αμίνη και η δραστική ένωση υδρογόνου είναι επαρκώς ενεργοποιημένη, η αντίδραση ονομάζεται συμπύκνωση Knoevenagel.
- Σε μια αντίδραση Perkin η αλδεΰδη είναι αρωματική και το ενολικό παράγεται από έναν ανυδρίτη.
- H συμπύκνωση Claisen-Schmidt μεταξύ μιας αλδεΰδης ή κετόνης που έχει ένα α-υδρογόνο με μια αρωματική καρβονυλική ένωση που στερείται α-υδρογόνου.
- Μια συμπύκνωση Claisen περιλαμβάνει δύο εστερικές ενώσεις.
- Μια συμπύκνωση Dieckmann περιλαμβάνει δύο εστερικές ομάδες στο "ίδιο μόριο" και αποδίδει ένα κυκλικό μόριο
- Στη συμπύκνωση Japp–Maitland το νερό απομακρύνεται όχι με μια αντίδραση απόσπασης αλλά με μια πυρηνόφιλη μετατόπιση
- Ένας σχηματισμός δακτυλίου (Robinson annulation) περιλαμβάνει μια α,β-ακόρεστη κετόνη και ένα καρβονύλιο, που εμπλέκονται αρχικά σε μια αντίδραση Michael πριν από την αλδολική συμπύκνωση.[2]
- Στην αντίδραση Guerbet, μια αλδεΰδη, που σχηματίζεται in situ από μια αλκοόλη, αυτοσυμπυκνώνεται στη διμερισμένη αλκοόλη.
Παραπομπές
Επεξεργασία- ↑ Smith, M. B.· March, J. (2001). Advanced Organic Chemistry (5th έκδοση). New York: Wiley Interscience. σελίδες 1218–1223. ISBN 0-471-58589-0.
- ↑ 2,0 2,1 Carey, Francis A.· Sundberg, Richard J. (1993). Advanced Organic Chemistry Part B Reactions and Synthesis (3rd έκδοση). New York, NY: Plenum. σελίδες 55. ISBN 0-306-43440-7.
- ↑ Wade, L. G. (2005). Organic Chemistry (6th έκδοση). Upper Saddle River, NJ: Prentice Hall. σελίδες 1056–1066. ISBN 0-13-236731-9.
- ↑ Mahrwald, R. (2004). Modern Aldol Reactions . 1, 2. Weinheim, Germany: Wiley-VCH. σελίδες 1218–1223. ISBN 3-527-30714-1.
- ↑ Heathcock, C. H. (1991). Additions to C-X π-Bonds, Part 2. Comprehensive Organic Synthesis. Selectivity, Strategy and Efficiency in Modern Organic Chemistry. 2. Oxford: Pergamon. σελίδες 133–179. ISBN 0-08-040593-2.
- ↑ Mukaiyama T. (1982). «The Directed Aldol Reaction». Organic Reactions 28: 203–331. doi:. ISBN 0471264180.
- ↑ Paterson, I. (1988). «New Asymmetric Aldol Methodology Using Boron Enolates». Chemistry and Industry (London: Paterson Group) 12: 390–394.
- ↑ Nielsen, A. T.; Houlihan., W. J. (1968). «The Aldol Condensation». Organic Reactions 16: 1–438. doi:. ISBN 0471264180.
- ↑ Perrin, C. L.; Chang, K. L. (2016). «The Complete Mechanism of an Aldol Condensation». J. Org. Chem. 81 (13): 5631–5. doi:. PMID 27281298. https://escholarship.org/uc/item/4786g54b.
- ↑ Carey, Francis A.· Sundberg, Richard J. (1993). Advanced Organic Chemistry Part A: Structure and Mechanisms (3rd έκδοση). New York, N.Y.: Plenum. σελίδες 458. ISBN 0-306-43440-7.
- ↑ Sanyal, S.N. (2003). Reactions, Rearrangements and Reagents (4th έκδοση). Daryagunj, New Delhi: Bharati Bhavan Publishers (P&D). σελ. 80. ISBN 978-81-7709-605-7.
- ↑ Graduated hydrogenation of aldox aldehydes to alcohols US US3118954A
- ↑ Schurink, H. B. J. (1925), «Pentaerythritol», Org. Synth. 4: 53, doi:, http://www.orgsyn.org/orgsyn/orgsyn/prepContent.asp?prep=CV1P0425; Coll. Vol. 1: 425
- ↑ Badía, C.; Castro, J. M.; Linares-Palomino, P. J.; Salido, S.; Altarejos, J.; Nogueras, M.; Sánchez, A. (2004). «(E)-6-(2,2,3-Trimethyl-cyclopent-3-enyl)-hex-4-en-3-one». Molbank 2004 (1): M388. doi:.
- ↑ Ethyl 2-methylacetoacetate (2) is added to a stirred solution of sodium hydride in dioxane. Then campholenic aldehyde (1) is added and the mixture refluxed for 15 h. Then 2N hydrochloric acid is added and the mixture extracted with diethyl ether. The combined organic layers are washed with 2N hydrochloric acid, saturated sodium bicarbonate and brine. The organic phase is dried over anhydrous sodium sulfate and the solvent evaporated under reduced pressure to yield a residue that is purified by vacuum distillation to give 3 (58%).
- ↑ Varela, J. A.; Gonzalez-Rodriguez, C.; Rubin, S. G.; Castedo, L.; Saa, C. (2006). «Ru-Catalyzed Cyclization of Terminal Alkynals to Cycloalkenes». Journal of the American Chemical Society 128 (30): 9576–9577. doi:. PMID 16866480.
